Nasturtium officinale R. BR.
Nastrutii herba – Nasturii herba syn. Cardamines herba
Die frischen oder getrockneten oberirdischen Teile von Nasturtium officinale R. BR. [4]
Allgemeines
Die Resistenz von Mikroorganismen ist ein zunehmendes Problem der globalen Gesundheitsversorgung, und zwar in solch einem großen Ausmaß, dass die Weltgesundheitsorganisation (WHO) mikrobielle Resistenzen zu einer der Top 10 Gesundheitsbedrohungen für die Menschheit erklärt hat. Infektionen, die durch antibiotikaresistente Keime verursacht werden, sind schwierig und manchmal unmöglich zu behandeln. In den meisten Fällen erfordern sie verlängerte Krankenhausaufenthalte, zusätzliche Nachuntersuchungen beim Arzt und kostspielige Alternativen, die selbst negative Auswirkungen auf die Gesundheit haben können. [1]
Der ausufernde und unverantwortliche Einsatz von Antibiotika führte dazu, dass Mikroorganismen sich wappnen und ihre Überlebenschancen erhöhen mussten. Sie machen sich, um das Fortbestehen ihrer Stämme zu sichern, vielfältige Mechanismen zunutze, einer dieser Mechanismen ist der Zusammenschluss zu einem sogenannten Biofilm. In Biofilmen liegen Populationen von Mikroorganismen organisiert in einer dünnen, schützenden Polysaccharid-Schicht vor. Biofilm-assoziierte Bakterien sind weniger empfindlich gegenüber Antibiotika als freilebende (planktonische) Zellen. Darüber hinaus sind die mikrobiellen Zellen bei Schwankungen der Antibiotika-Konzentration in einem Biofilm oft Konzentrationen ausgesetzt, die unterhalb der Hemmkonzentration liegen, so können sie Resistenzen entwickeln. Dies führt zur Selektion von Erregern, die nur schwer auszurotten sind. Ein Beispiel für gehäuften Gebrauch von Antibiotika sind unkomplizierte Harnwegsinfektionen. Fachleute argumentieren mittlerweile, dass die Behandlung und Prävention unkomplizierter Harnwegsinfekte an einem Wendepunkt steht und der Nutzen einer empirischen Antibiotikatherapie möglicherweise nicht mehr den individuellen und gesellschaftlichen Risiken überwiegt. [2]
Ein großes Potential zur Bekämpfung bakterieller Infektionen stellen die sekundären Pflanzenstoffe dar, sie werden auf Grund ihre vielfältigen Eigenschaften immer mehr als Alternative oder Ergänzung zu Antibiotika in Betracht gezogen. Eine Gruppe pflanzlicher Substanzen mit solchen Eigenschaften sind die Glucosinolate (GLS). Es handelt sich um schwefelorganische Verbindungen, die in der Familie der Brassicaceae reichlich vorhanden sind. Sie kommen als Sekundär-Metabolite in verschiedenen Gemüsesorten wie Brunnenkresse, Meerrettich, Kohl-Arten und Brokkoli vor. Werden ihre Zellwände beschädigt kommt es zur Spaltung der Glucosinolate durch die, in anderen Zellkompartimenten gelagerte, Myrosinase. Die entstehenden Glucosinolat-Hydrolyseprodukte, vor allem die Isothiocyanate, sind seit langem für ihre antimikrobielle Aktivität gegen wichtige pathogene Mikroorganismen bekannt.
Die Pflanzenmonografie wurde mit freundlicher Genehmigung auf Basis der Diplomarbeit „Arzneipflanzenportraits ausgewählter Arzneidrogen“ (Mag. pharm. Antonia Kresnik) erstellt.
References
1. WHO Antimicrobial Resistance Division. 2020 antibacterial agents in clinical and preclinical development: an overview and analysis. World Health Organization. 2021 Apr 15. Available from: https://www.who.int/publications/i/item/9789240021303 [updated 2021 Apr 15; cited 2021 Jul 5].
2. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Dis Mon. 2003; 49:53–70. doi: 10.1067/mda.2003.7 PMID: 12601337.
3. World Flora Online. Nasturtium officinale R.Br [updated 30 Jun 2021; cited 30 Jun 2021]. Available from: http://www.worldfloraonline.org/taxon/wfo-0000380323.
4. Kommission E Monographie BGA/BfArM. Nasturtii herba (Brunnenkressekraut). Monographie BGA/BfArM. ; 1990.
5. Homöopathisches Arzneibuch. Nasturtium officinale. ; 2020.
6. Bäumler S. Arzneipflanzenporträts. 2nd ed. München: Elsevier Urban & Fischer; 2012.
7. Rubin E, Aziz Z, Surugau N. Glucosinolates content of in vitro grown Nasturtium officinale (watercress). ASM Science Journal. 2018:132–9. Available from: https://www.researchgate.net/profile/Noumie-Surugau/publication/330411566_Glucosinolates_content_of_in_vitro_grown_Nasturtium_officinale_watercress/links/5c3eeccea6fdccd6b5b08cff/Glucosinolates-content-of-in-vitro-grown-Nasturtium-officinale-watercress.pdf.
8. Blaschek W, Wichtl M, Bauer R, Buff W, Classen B, Heise EM, et al., editors. Wichtl – Teedrogen und Phytopharmaka. Ein Handbuch für die Praxis. 6th ed. Stuttgart: WVG Wissenschaftliche Verlagsgesellschaft; 2016.
9. Schilcher H, Kammerer S, Wegener T, Volkmann D, editors. Leitfaden Phytotherapie. 4th ed. München: Elsevier Urban & Fischer; 2010.
10. Stoffliste des Bundes und der Bundesländer. Kategorie „Pflanzen und Pflanzenteile“. Basel: Springer; 2014.
11. Rose P, Faulkner K, Williamson G, Mithen R. 7-Methylsulfinylheptyl and 8-methylsulfinyloctyl isothiocyanates from watercress are potent inducers of phase II enzymes. Carcinogenesis. 2000; 21:1983–8. doi: 10.1093/carcin/21.11.1983 PMID: 11062158.
12. Hofmann T, Kuhnert A, Schubert A, Gill C, Rowland IR, Pool-Zobel BL, et al. Modulation of detoxification enzymes by watercress: in vitro and in vivo investigations in human peripheral blood cells. Eur J Nutr. 2009; 48:483–91. Epub 2009/07/28. doi: 10.1007/s00394-009-0039-5 PMID: 19636603.
13. Telang U, Ji Y, Morris ME. ABC transporters and isothiocyanates: potential for pharmacokinetic diet-drug interactions. Biopharm Drug Dispos. 2009; 30:335–44. doi: 10.1002/bdd.668 PMID: 19623673.
14. Romeo L, Iori R, Rollin P, Bramanti P, Mazzon E. Isothiocyanates: An Overview of Their Antimicrobial Activity against Human Infections. Molecules. 2018; 23:1–18. Epub 2018/03/09. doi: 10.3390/molecules23030624 PMID: 29522501.
15. Borges A, Abreu AC, Ferreira C, Saavedra MJ, Simões LC, Simões M. Antibacterial activity and mode of action of selected glucosinolate hydrolysis products against bacterial pathogens. J Food Sci Technol. 2015; 52:4737–48. Epub 2014/09/14. doi: 10.1007/s13197-014-1533-1 PMID: 26243895.
16. Kaiser SJ, Mutters NT, Blessing B, Günther F. Natural isothiocyanates express antimicrobial activity against developing and mature biofilms of Pseudomonas aeruginosa. Fitoterapia. 2017; 119:57–63. Epub 2017/04/05. doi: 10.1016/j.fitote.2017.04.006 PMID: 28390975.
17. Mutters NT, Mampel A, Kropidlowski R, Biehler K, Günther F, Bălu I, et al. Treating urinary tract infections due to MDR E. coli with Isothiocyanates – a phytotherapeutic alternative to antibiotics. Fitoterapia. 2018; 129:237–40. Epub 2018/07/19. doi: 10.1016/j.fitote.2018.07.012 PMID: 30031115.
18. Jeong Y-J, Cho H-J, Chung F-L, Wang X, Hoe H-S, Park K-K, et al. Isothiocyanates suppress the invasion and metastasis of tumors by targeting FAK/MMP-9 activity. Oncotarget. 2017; 8:63949–62. Epub 2017/07/12. doi: 10.18632/oncotarget.19213 PMID: 28969043.
19. Herz C, Márton M-R, Tran HTT, Gründemann C, Schell J, Lamy E. Benzyl isothiocyanate but not benzyl nitrile from Brassicales plants dually blocks the COX and LOX pathway in primary human immune cells. Journal of Functional Foods. 2016; 23:135–43. doi: 10.1016/j.jff.2016.02.034.
20. Sadeghi H, Mostafazadeh M, Sadeghi H, Naderian M, Barmak MJ, Talebianpoor MS, et al. In vivo anti-inflammatory properties of aerial parts of Nasturtium officinale. Pharm Biol. 2014; 52:169–74. Epub 2013/10/25. doi: 10.3109/13880209.2013.821138 PMID: 24160746.
21. De Souza, Costa, Ribeiro. Daily intake of watercress causes inhibition of experimental Ehrlich tumor growth. Jornal Brasileiro de Patologia e Medicina Laboratorial. 2016; 52:393–9. doi: 10.5935/1676-2444.20160063.
22. Thiel, Ardjomand-Wölkart. Eine Extraktkombination aus Cranberry, Brunnenkresse und Meerrettich in der Anwendung bei Frauen mit unkompliziertem Harnwegsinfekt Lower Urinary Tract Infectbei Frauen mit unkompliziertem Harnwegsinfekt // A Complex Preparation of Cranberry, Horseradish and Watercress in the Treatment of Non-Severe Lower Urinary Tract Infect. Journal für Urologie und Urogynäkologie. 2016:4–9. Available from: https://www.kup.at/kup/pdf/13760.pdf.
23. Stange R, Schneider B, Albrecht U, Mueller V, Schnitker J, Michalsen A. Results of a randomized, prospective, double-dummy, double-blind trial to compare efficacy and safety of a herbal combination containing Tropaeoli majoris herba and Armoraciae rusticanae radix with co-trimoxazole in patients with acute and uncomplicated cystitis. Res Rep Urol. 2017; 9:43–50. Epub 2017/03/14. doi: 10.2147/RRU.S121203 PMID: 28352615.
24. Sedaghattalab M, Razazan M, Shahpari M, Azarmehr N, Larki RA, Sadeghi H, et al. The Effect of the Hydroalcoholic Extract of Watercress on the Levels of Protein Carbonyl, Inflammatory Markers, and Vitamin E in Chronic Hemodialysis Patients. Biochem Res Int. 2021; 2021:5588464. Epub 2021/05/26. doi: 10.1155/2021/5588464 PMID: 34136285.
25. Yuan J-M, Stepanov I, Murphy SE, Wang R, Allen S, Jensen J, et al. Clinical Trial of 2-Phenethyl Isothiocyanate as an Inhibitor of Metabolic Activation of a Tobacco-Specific Lung Carcinogen in Cigarette Smokers. Cancer Prev Res (Phila). 2016; 9:396–405. Epub 2016/03/07. doi: 10.1158/1940-6207.CAPR-15-0380 PMID: 26951845.


Die ausdauernde mehrjährige Krautpflanze wird normalerweise 0,25 bis 0,9 m hoch, kann in fließendem Wasser aber sogar noch größer werden. Sie hat kriechende oder schwimmende hohle beblätterte, verzweigte Stängel, von denen die niederliegenden an den Knoten häufig Adventiv-Wurzeln, aber keine Pfahlwurzel haben. Die Stängel sind in den Achseln der Zweige kahl oder pelzig behaart, von unterschiedlicher Dicke, weich, kantig und gefurcht. Die Blätter sind unpaarig gefiedert mit 3 – 9 Fiederblättchen, sie wachsen wechselständig und sind grasgrün und fleischig. Die unteren Stängelblätter sind länger gestielt und ein- bis fünfzählig gefiedert, die oberen Blätter sind kurz gestielt und leierförmig gefiedert mit fünf bis neun Fiederblättchen. Am Grund tragen sie kurze abstehende Öhrchen. Die Fiederblättchen in der Mitte sind eiförmig oder elliptisch, ganzrandig oder mit wellenförmig eingekerbtem Rand. Das rundliche bis breit-eiförmige Endblättchen mit herzförmigem Grund ist merklich größer und hat ebenfalls einen eingekerbten Rand. Nur die Oberseite der Blattspindel ist behaart mit vereinzelten 0,1 bis 0,3 mm langen Härchen. Die endständigen Blütenstände sind doldig gestaucht, sie befinden sich an Haupt- und Seitensprossen und wachsen traubenartig. Die Blütenstiele tragen kleine weiße Blüten, die mit winzigen 0,1 mm langen Haaren besetzt sind. Aus vier Kelchblättern, vier Kronblättern und sechs Staubblättern bilden sich die Blüten. Von den etwa 2 mm langen Kelchblätter sind die beiden äußeren am Grund sackartig erweitert. Die vier weißen Kronblätter haben eine verkehrt-eiförmige Form mit einer ganzrandigen Platte, die sich in einen langen Nagel verschmälert. Die sechs Staubblätter sind in zwei Kreisen angeordnet, an den Seiten der beiden äußeren, kürzeren Staubblättern befinden sich kleine grüne kontenförmige Honigdrüsen. Die vier innen liegenden Staubblätter sind 3 bis 3,5 mm lang, die Staubbeutel haben eine gelbe Farbe. [5]
Die Brunnenkresse blüht in den Monaten Mai bis August, ihre Früchte sind 12 – 18 mm lange, waagrecht abstehende Schoten, die etwa 1 mm große Samen enthalten. Verwechslungsgefahr besteht mit dem Schaumkraut (Cardamine amara L.), dieses wächst in Europa und im westasiatischen Raum, ist aber durch seine violetten Antheren und nur drei Fiederblättchen, leicht von der Brunnenkresse mit ihren gelben Antheren zu unterscheiden. Eine Verwechslung wäre jedoch ohnehin unkritisch, da das Bittere Schaumkraut ungiftig ist und ähnliche Eigenschaften wie die Brunnenkresse besitzt. [6]
Droge
Das Brunnenkressen-Kraut kann das ganze Jahr geerntet werden, die größten Anbaugebiete sind in Ost- und Südeuropa. Der Geruch der Brunnenkresse ist schwach würzig, doch der Geschmack bitter und scharf. Es werden Tees (Infus), Frischpflanzenpresssäfte, Urtinkturen und Fertigarzneimittel hergestellt. [6]
Verwendet werden die frischen oberirdischen Teile von Nasturtium officinale zur Blütezeit. Aus ihnen werden wässrig alkoholische Urtinkturen ohne Wärmebehandlung hergestellt, aus denen flüssige Verdünnungen zubereitet werden können. Die Urtinktur ist eine Flüssigkeit von grünlich brauner Farbe mit charakteristischem Geruch. [5]
Bestandteile
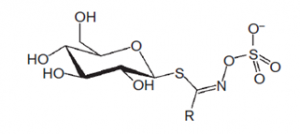 Abbildung: Die Grundstruktur der Glucosinolate.
Abbildung: Die Grundstruktur der Glucosinolate.
Die wirksamkeitsbestimmenden Bestandteile der Brunnenkresse und des Meerrettichs sind die Senfölglykoside oder Glucosinolate, von denen 2-Phenylethylglucosinolat, bekannt als Gluconasturtiin, am höchsten konzentriert ist. Die Senfölglykoside oder Thiolglykoside gehören, wie der Name schon sagt, der Stoffgruppe der Glykoside an und bestehen strukturell aus einem Aglykon, das über ein Schwefelatom an einen Zucker gebunden ist. Diese sekundären Pflanzenstoffe kommen vorwiegend in Kreuzblütlern wie Kresse, Meerrettich, Senf und Kohl vor, die ihnen ihren bitteren, scharfen Geschmack zu verdanken haben. Thiolglykoside sind schwefel- und stickstoffhaltige Verbindungen, die vorwiegend in der frischen Pflanze vorkommen, da bei der Ernte ein Großteil von ihnen verloren geht. Werden nämlich die Zellwände der Pflanzen verletzt, wird die, für die Kreuzblütler typische, Myrosinase (β-Thiolglucosidase) freigesetzt. Die Myrosinase ist ein pflanzliches Enzym, das räumlich getrennt von ihrem Substrat, dem Senfölglykosid, vorliegt und es bei Kontakt in Glucose und Senföle spaltet. Wird die Zellstruktur durch Trocknung oder falsche Lagerung zerstört, gehen auch die flüchtigen Senföle und mit ihnen die Hauptwirkstoffe der Pflanzen verloren. [6]
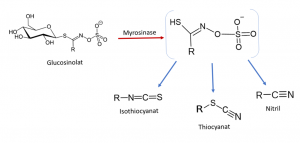
Abbildung: Der Abbau von Glucosinolaten durch die Myrosinase. (Eigene Formelzeichnung)
Brunnenkresse (Nasturtium officinale) ist eine reiche Quelle von Phenylethylglucosinolat (Gluconastrutiin) und Benzylglucosinolat (Glucotropaeolin), den Vorläufern von Phenylethylisothiocyanat (PEITC) und Benzylisothiocyanat (BITC). [7]
Das frische Kraut ist reich an Vitamin C, das bei der Myrosinase-Reaktion als Coenzym wirkt und diese noch beschleunigen kann. [6,8]
Im frischen Kraut:
- Glucosinolate: 0,1 bis 0,9 %
- Gluconastrutiin: 80 %
- Glucohirsutin
- Glucotropaeolin
- Glucobrassicin
- Flavonoide (Apigenin, Kämpferol, Quercetin, Rutin)
- Ascorbinsäure (80 mg / 100 g Kraut)
- Mineralstoffe
- Spurenelemente
In den getrockneten Blättern:
- Isothiocyanate
- 2-Phenylethyl-ITC (PEITC)
- Hirsutin (8-Methylsulfinylocytl-ITC)
- Benzyl-ITC (BITC)
- Indol-3-ylmethyl-ITC
- Sulforaphan
- Nitrile
- 3-Phenyl-proprionitril
- Myristicin
[6–8]
Der lateinische Name „Nasturtium“ kommt von „nasus = Nase“ und „torquere = quälen“, bezugnehmend auf den scharfen, senfähnlichen Geruch der Brunnenkresse. Im Mittelalter setzte man das Kraut ein, um den Stoffwechsel zu verbessern und eingeschränkte Leber- und Gallenfunktion wieder herzustellen. Außerdem verwendete man es bei Schwindsucht, Bronchitis und Skorbut. Dioskurides beschreibt sie als harntreibende, erwärmende Pflanze, die auch Sonnenbrandflecken durch Auflegen vertreiben soll. Beliebt war sie auch als Frühjahrskur in Form von Wildsalaten, wegen ihres hohen Vitamin C Gehaltes wurde sie gemeinsam mit Brennnessel verzehrt. Zusätzlich wurde sie als Stomachikum verwendet und bei Appetitlosigkeit oder Verdauungsbeschwerden eingesetzt. Äußerlich wurde die Brunnenkresse bei rheumatischen Beschwerden und Gicht verwendet und in der iranischen Volksheilkunde sogar gegen kardiovaskuläre Erkrankungen genutzt. Pulverisiert und als Paste auf die Kopfhaut aufgetragen, wurde der Brunnenkresse eine positive Wirkung auf das Haarwachstum nachgesagt, was möglicherweise mit dem Vitamin B Gehalt zusammenhängt. [6]
Zulassung laut BfArM
Das Kraut der Brunnenkresse Nasturtium officinale R. BR. ist zugelassen als Lebensmittel und traditionelles Arzneimittel, sowie als ein Stoff, für den eine Beschränkung bei der Verwendung in Lebensmitteln empfohlen wird (Liste B). [10]
Kommission E / ESCOP / EMA / HMPC
Es besteht eine Positiv-Monographie der Kommission E zum Brunnenkressekraut für die Anwendung bei Katarrhen der Atemwege. [4] Von der ESCOP und dem HMPC wurde das Brunnenkressekraut bisher noch nicht bearbeitet.
Indikationen auf Grund von Anwendungsbeobachtungen
Anwendung auf Grund von Erfahrungsberichten bei entzündlichen Erkrankungen der ableitenden Harnwege. [9]
Teezubereitungen (wenig gebräuchlich). 2 g Droge 10 min in heißem Wasser ziehen lassen. [6,8]
Als Frischpflanzenpresssaft. [6,8]
In homöopathischen Arzneimitteln. [5]
Unerwünschte Wirkungen
Reizungen der Magenschleimhaut sind möglich bei hoher Dosierung und Langzeit-Einnahme. [6,8]
Gegenanzeigen/Anwendungsbeschränkungen
Magen- und Darmulzera und entzündliche Nierenerkrankungen. Keine Anwendung bei Kindern unter 4 Jahren. [6]
Wechselwirkungen
Keine bekannt. [6,9]
Pharmakokinetik
Es wird angenommen, dass Glucosinolate Phase-I- und Phase-II-Enzyme modulieren können. Brunnenkresse beinhaltet zwei strukturell unterschiedliche Gruppen von Glucosinolat-Metaboliten mit biologischer Aktivität. Zum einen β-Phenylethylisothiocyanat (PEITC), abgeleitet von Phenylalanin, das Phase-I-Enzyme (Cytochrom P450) hemmt und Phase-II-Enzymen induziert und zum anderen langkettige Methylsulfinylalkyl-Isothiocyanate, abgeleitet von Methionin, die potente Phase-II-Enzyminduktoren sind. [11]
Brunnenkresse-Saft kann in vitro und in vivo die Enzym-Aktivitäten der Superoxid-Dismutase-2 (SOD2) und Glutathion-Peroxidase-1 (GPX) in Blutzellen erhöhen. [12] Isothiocyanate interagieren auch mit ATP-binding-cassette-Efflux-Transportern (ABC-Transporter) wie P-Glykoprotein (P-gp, ABCB1), Multidrug-Resistance-Protein-1 (MRP1, ABCC1), Multidrug-Resistance-Protein-2 (MRP2, ABCC2) and Breast-Cancer-Resistance-Protein (BCRP, ABCG2) und können dadurch die Pharmakokinetik von Substraten dieser Transporter beeinflussen. [13]
Der Metabolismus von Glucosinolaten im menschlichen Körper erfolgt beginnend mit ihrer Absorption durch die gastrointestinale Schleimhaut. Der größte Teil der aufgenommenen Glucosinolate wird im Darmlumen metabolisiert, insbesondere wenn rohes Brassica-Gemüse verzehrt wird. Die Myrosinase hydrolysiert die Glucosinolate und verschiedene Metaboliten, einschließlich Isothiocyanate, aber auch Nitrile, Oxazolidin-2-thione und Indol-3-carbinole, die dann im Magen und Dünndarm absorbiert werden. Senföle, die aus gekochtem Brassica-Gemüse stammen (inaktivierte Myrosinase) gelangen, da sie noch intakt und hydrophil sind, in den Dickdarm (Thioglukose- und Sulfatgruppen), wo sie von Mikroorganismen zu Glucosinolat-Abbauprodukten hydrolysiert und schließlich von der Schleimhaut absorbiert werden. Die höchsten Mengen an ITC finden sich in der Darmschleimhaut, der Leber, den Nieren und der Harnblase, gefolgt von Lunge und Milz. Die absorbierten ITC gelangen in die Leber, wo sie mit Glutathion konjugiert und schließlich als Mercaptursäure im Urin ausgeschieden werden. Die Bioverfügbarkeit der ITC und damit ihre Elimination hängt insbesondere von der Art der Glucosinolat-Hydrolyse und von ihrem Gehalt ab. [14]
In-vitro-Studien
Antibakterieller Effekt
In einer Publikation von Borges et al. untersuchte man die antimikrobielle Aktivität und Wirkungsweise von AITC und PEITC gegen Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus und Listeria monocytogenes. Zu diesem Zweck wurden einerseits die minimale Hemmkonzentration (MHK) und die minimale bakterizide Konzentration (MBC) bestimmt und andererseits die, durch die Istohiocyanate induzierten, physiologischen Veränderungen an den Bakterienzellen betrachtet. Die Analyse der antimikrobiellen Aktivität zeigte, dass AITC und PEITC eine MHK von 100 μg/mL gegen alle getesteten Bakterien aufwiesen. Sie wirkten beide durch Veränderung der Membraneigenschaften der Bakterien und verringerten dadurch ihre Oberflächenladung und beeinträchtigen die Integrität der
Zytoplasma-Membran, was zu Kaliumverlusten führte. Zudem konnten unspezifische Auswirkungen auf die Oberflächenhydrophobie beobachtet werden. Durch diese verschiedenen Wirkmechanismen wird vor allem die Bildung von Resistenzen der Mikroorganismen deutlich erschwert. [15]
Alle einzelnen Isothiocyanate konnten in einer 2017 durchgeführten In-vitro-Studie planktonische Pseudomonas aeruginosa und auch bereits entstandene Biofilme terminieren. Es wird vermutet, dass sogar schon geringe Konzentrationen an ITC die Biofilmbildung verhindern, die Lebensfähigkeit des Biofilms stören und die Wirkung von Antibiotika synergistisch erleichtern, auch wenn das Wachstum nicht komplett gehemmt werden kann. [16]
Uropathogene Escherichia coli (UPEC) sind eine Spezies, die besonders häufig bei Harnwegsinfektionen isoliert wird. Sie sind in der Lage, die antibiotische Behandlung durch Internalisierung zu überleben und Rezidive zu verursachen. Es wurden 217 klinische UPEC-Isolate, von denen 54,5 % als Antibiotika-resistent (MDR) klassifiziert wurden, auf Empfindlichkeit gegen die Isothiocyanate Allyl-ITC, Benzyl-ITC und 2-Phenylethyl-ITC, getestet. Die minimalen Hemmkonzentrationen (MHK) reichten von < 0,02 bis 0,67 mg ITC/ml. Die mittlere Gesamt-MHK-90 zeigte, dass eine Konzentration von 0,17 mg ITC/ml notwendig war, um das sichtbare bakterielle Wachstum in 90 % (200/217) aller getesteten Stämme zu hemmen. Die Daten wiesen auf eine starke antimikrobielle Aktivität der ITC gegen UPEC, dargestellt durch sehr niedrige MHK-90-Werte, hin. Zusätzlich waren die ITC in der Lage die Internalisierung von UPEC in menschliche Uroepithelzellen, insbesondere nach längerer Inkubationszeit, zu hemmen. [17]
Antiproliferative Wirkung
Isothiocyanate können die Invasion und Metastasierung von Tumoren unterdrücken. Von den verschiedenen Isothiocyanaten zeigten besonders Benzylisothiocyanat (BITC), Phenethylisothiocyanat (PEITC) und Sulforaphan (SFN aus dem Brokkoli) gute Wirksamkeit in präklinischen Krebsmodellen. Sie scheinen über verschiedene Mechanismen wie Induktion von Apoptose und oxidativem Stress sowie Hemmung der Zellzyklusprogression zu wirken. Darüber hinaus regulieren sie verschiedene Signalwege und hemmen die Expression und Aktivität von Matrix-Metalloproteinasen (MMP-9 und MMP-2). MMP-9 und MMP-2 sind Schlüsselenzyme, die mit der Tumorinvasion, dem Abbau von Knochengewebe und der Angiogenese in Verbindung gebracht werden. Die Aktivität von MMP-9 wird durch Wachstumsfaktoren (Aktivatorprotein 1 (AP-1), Nuclear Factor κB (NF-κB) und Zytokine erhöht und die Sekretion durch die fokale Adhäsionskinase (FAK) gefördert. PEITC unterdrückte sowohl die MMP-2-Aktivität als auch die TPA-induzierte MMP-9-Aktivität in U20S-, Caski- und T98G-Zellen in dosisabhängiger Weise. BITC, PEITC und SFN hemmten außerdem die Aktivität von AP-1 und NF-κB. Um schließlich zu untersuchen, ob Isothiocyanate das Tumorwachstum auch in vivo hemmen, wurden Mäusen A549-Zellen-Tumorzellen injiziert. Nachdem der Tumor eine Größe von 5 mm erreicht hatte, wurden den Mäusen 5 Wochen lang intraperitoneal die Isothiocyanat-Verbindungen verabreicht. Die maximale Tumorgröße in PEITC-behandelten Mäusen war deutlich kleiner als in den anderen Gruppen. Ki67, ein Marker der Zellproliferation, wurde durch Isothiocyanate, aber nicht durch das Vehikel unterdrückt. Diese Ergebnisse deuten darauf hin, dass Isothiocyanate die Proliferation von A549-Zellen und die anschließende Tumorentwicklung blockieren können. [18]
Entzündungshemmende Wirkung
Die Arachidonsäure (AA) ist ein wichtiger Marker der Entzündungsreaktion, sie wird unter anderem von Bakterien durch Freisetzung von Lipopolysacchariden (LPS) aus ihrer Membran erzeugt. AA kann über zwei Hauptwege weiter verstoffwechselt werden, den Cyclooxygenase- (COX) und den Lipoxygenase-Stoffwechselweg (LOX). Bislang wurden drei Isoformen der COX identifiziert. COX-2 ist eines der wichtigsten Enzyme bei der Entzündungsreaktion, da es entscheidend für die Bildung von Prostaglandinen ist, wobei Prostaglandin E2 (PGE2) verantwortlich für Symptome wie Fieber und Schmerzen ist. In den letzten Jahren wurde die duale Hemmung sowohl des COX- als auch des LOX-Signalwegs als ein vielversprechender neuer Ansatz zur Entzündungshemmung mit keiner oder nur geringer Toxizität angesehen. Die duale Hemmung des COX/LOX-Signalweges durch Benzyl-ITC (BITC) oder seinem Nitril-Pendant wurden an Zellen des menschlichen Immunsystems untersucht. Verwendet wurden aktivierte primäre menschliche mononukleäre Blutzellen (PBMC). Es wurde gezeigt, dass BITC, nicht aber Benzylnitril oder Phenylethylnitril, die zelluläre proinflammatorische Reaktion über den dualen COX/LOX-Signalweg vermindern kann. Benzyl-ITC unterdrückte außerdem die durch LPS ausgelöste Aktivierung des COX-Signalwegs in menschlichen PBMC. Benzyl-ITC blockierte weiters die Freisetzung von Leukotrien B4 (LTB4) in humanen PBMC und reduzierte die Aktivierung und Funktion von aktivierten T-Lymphozyten. [19]
In-vivo-Studien
Entzündungshemmende Wirkung
Ein erhöhter Verzehr von Pflanzen der Brassicaceae-Familie wurde mit einer Reduktion zahlreicher menschlicher Erkrankungen, insbesondere Tumorerkrankungen, in Verbindung gebracht. Um die Auswirkungen der täglichen Aufnahme einer wässrigen Lösung von Brunnenkresse auf das Tumor-Wachstum zu untersuchen, wurde das experimentelle Modell des Ehrlich-Tumors (EET) an Mäusen verwendet. Die Tiere der Kontrollgruppe A erhielten vom ersten Tag an eine Salzlösung. Die Tiere der Versuchsgruppe B erhielten vom ersten Tag an 0,05 ml wässrige Lösung von Nasturtium officinale (0,5 g/ml) und die Tiere der Gruppe C bekamen die Brunnenkresse-Lösung erst ab Tag 21. Am einundzwanzigsten Tag wurden außerdem die experimentellen Ehrlich-Tumor-Zellen subkutan in die Pfoten der Tiere eingeimpft. Die Tumor-Aktivität wurde durch Messung der Dicke der Pfoten beurteilt. Nach 42 Tagen zeigten sich sowohl bei Tieren aus der Gruppe B als auch aus Gruppe C, supprimiertes Tumor-Wachstum und nur kleine Nekrose-Flächen im Gegensatz zu den Tieren aus Gruppe A. Die Ergebnisse deuteten darauf hin, dass die tägliche Aufnahme einer wässrigen Lösung von Brunnenkresse, sowohl vor als auch nach induziertem Tumorwachstum, chemopräventive und chemoprotektive Wirkungen haben könnte. [21]
Antiproliferative Wirkung
Obwohl Pfefferminzöl landläufig hauptsächlich als topisches Analgetikum bekannt ist, beweisen Studien an Nagetieren, dass es auch viszerale Schmerzen verringern kann, wenn es oral oder intraperitoneal verabreicht wird. [42] Diese Schmerzminderung ist auf die Hemmung von TRPM8- und/oder TRPA1-Rezeptoren der Superfamilie der Transient-Receptor-Potential-Kationenkanäle, die sich im Darm befinden, zurückzuführen. [29,30]
Harnwegsinfektionen
In einer Beobachtungsstudie wurden 48 Frauen, die an Harnwegsinfektionen (HWI) litten, mit einem standardisierten Cranberry-Extrakt (67 mg Proanthocyanidine) in Kombination mit glucosinolathaltigen Extrakten von Brunnenkresse (Nasturtium officinale) und Meerrettich (Armoracia rusticana) behandelt. Die klinischen Symptome waren erhöhte Leukozyten-Werte im Urin, Dysurie, Harndrang, Inkontinenz und Schmerzen. Die Probandinnen erhielten in der ersten Woche zweimal tägliche eine der Tabletten des Kombinations-Phytotherapeutikums. In den darauffolgenden vier Wochen nahmen sie nur mehr eine Tablette täglich ein. Nach 14 (t1) und nach 35 (t2) Tagen wurde eine Befragung und Kontrolluntersuchung mit einem Urintest durchgeführt. Patientinnen mit anhaltenden klinischen Symptomen erhielten ein Antibiotikum, bei den anderen wurde die Einnahme der Tabletten mit dem Extrakt-Präparat fortgesetzt. Bei 34 Patientinnen (70,8 %) konnten die Einnahme von Antibiotika innerhalb der ersten 14 Tagen vermieden werden, bei 32 Patientinnen (66,7 %) wurde auch danach keine antibiotische Therapie benötigt. 28 Patientinnen (87,5 %) waren zum Zeitpunkt t2 symptomfrei. Es wurden keine unerwünschten Ereignisse beobachtet. Die Kombination von Brunnenkresse, Meerrettich und Cranberry kann bei Harnwegsinfekten hilfreich sein, die körpereigene Abwehr zu stärken und den Zusatz von Antibiotika zu vermindern oder ganz auf sie zu verzichten. Außerdem könnten so Resistenzbildung vermieden und Rezidive verringert werden. [22]
In einer randomisierten, prospektiven, doppelblinden, aktiv-kontrollierten, multizentrischen, klinischen Studie der Phase III wurden ambulante PatientInnen zwischen 18 und 70 Jahren mit Symptomen einer akuten unkomplizierten Zystitis, vorhandenen Leukozyten und einer Keimzahl von mehr als 105 KBE/ml (Koloniebildende Einheiten) untersucht. Die Studienmedikation bestand aus entweder einem Kombinationspräparat mit 80 mg Meerrettichwurzelpulver und 200 mg Kapuzinerkrautpulver, dessen Isothiocyanat-Profil ähnlich dem der Brunnenkresse ist, oder dem Vergleichsstoff Co-Trimoxazol (160 mg Trimethoprim und 800 mg Sulfamethoxazol). Die Placebo-Tabletten waren vom Aussehen her identisch mit dem jeweiligen Studienmedikament. Der primäre Endpunkt war die Rate der Responder, definiert als die Reduktion der Erreger im Urin auf <103 KBE/ml beim dritten Arztbesuch. Sekundäre Endpunkte waren die Veränderung der Symptom-Scores, die Dauer der Symptome, die Beurteilung der Wirksamkeit durch die Ärzte, die Häufigkeit von Rückfällen oder Neuinfektionen beim dritten und vierten Arztbesuch sowie die Beurteilung des Krankheitsverlaufs durch die Ärzte. Obwohl die Nicht-Unterlegenheit für den primären Endpunkt in dieser Studie nicht nachgewiesen werden konnte, lagen die Responder-Raten für beide Therapien bei etwa 50 % und es wurde eine ähnliche Verbesserung der HWI-Symptome in beiden Gruppen beobachtet. 51 PatientInnen wurden als Per-Protokoll-PatientInnen betrachtet (22 in der Phytotherapie-Gruppe, 29 in der Antibiotika-Gruppe). Die Responder-Raten betrugen 10/22 (45,5 %) in der Phytotherapie-Gruppe und 15/29 (51,1 %) in der Antibiotika-Gruppe (Gruppenunterschied: -6,27 % [95 % CI: -33,90 %, -21,3 %]). Die Studie musste wegen zu geringer Rekrutierungsraten vorzeitig abgebrochen werden, trotzdem ergaben sich Hinweise auf eine vergleichbare Wirksamkeit. [23]
Nierenerkrankungen
Eine doppelblinde, randomisierte klinische Studie, die an 45 Hämodialyse-PatientInnen durchgeführt wurde, hatte zum Ziel, die Wirkung eines hydroalkoholischen Extrakts der Brunnenkresse auf die inflammatorischen Zytokine und den Protein-Carbonyl-Gehalt (PCO) bei chronischen Nierenerkrankungen zu untersuchen. Oxidativer Stress tritt vermehrt bei Nierenversagen und Hämodialyse auf und kann zu Proteinoxidation führen. Die Bildung von PCO in Proteinen geschieht durch direkte Oxidation über Reaktive Sauerstoffspezies (ROS). Die TeilnehmerInnen wurden nach dem Zufallsprinzip in zwei Gruppen aufgeteilt: 22 in der Interventionsgruppe (500 mg hydroalkoholischer Extrakt aus Brunnenkresse jeden Tag für 4 Wochen) und 23 in der Kontrollgruppe (500 mg Weißmehl jede Nacht für 4 Wochen). Die Spiegel von Vitamin E, PCO und inflammatorischen Zytokinen wurden zu Beginn und am Ende der Behandlung anhand von Blutproben bestimmt. In der Interventionsgruppe kam es zu einer signifikanten Reduktion der PCO-Werte (20,33 ± 4,40 vs. 15,06 ± 6,41, p = 0,001). Weiterhin gab es signifikante Reduktionen der Entzündungsmarker hochsensitives C-reaktives Protein (hs-CRP) (8953,30 ± 5588,06 vs. 7249,86 ± 5091,62, p = 0,007) und Interleukin 6 (IL-6) (60,10 vs. 55,21, p = 0,050) in der Interventionsgruppe, diese Veränderungen waren jedoch im Vergleich mit der Kontrollgruppe nicht signifikant. Der hydroalkoholische Extrakt der Brunnenkresse reduzierte, über die Hemmung der Proteinoxidation, den PCO-Gehalt bei Hämodialyse-PatientInnen. Obwohl die Verabreichung von Brunnenkresse eine signifikante Senkung der IL-6- und CRP-Werte bewirkte, waren diese Unterschiede im Vergleich zur Kontrollgruppe statistisch nicht signifikant. [24]
Antikarzinogene Wirkung
In einer klinischen, randomisierten, placebokontrollierten, doppelblinden, Phase-2 Crossover-Studie wurden 82 RaucherInnen untersucht, die täglich 10 – 45 Zigaretten konsumierten, 21 Jahre oder älter und in guter körperlicher Verfassung waren. Es wurde getestet ob das in der Brunnenkresse enthaltene 2-Phenethyl-Isothiocyanat (PEITC) ein Inhibitor der metabolischen Aktivierung des tabakspezifischen Lungen-Karzinogenes 4-(Methylnitrosamino)-1-(3-pyridyl)-1-butanon (NNK) sein könnte. NNK, das selektiv Lungentumore bei Nagetieren induziert, ist eines der potentesten Karzinogene im Tabakrauch. Die ProbandInnen wurden gebeten, während einer Akklimatisierungszeit von mindestens einer Woche, Zigaretten zu rauchen, die mit Deuterium markiertes [Pyridin-D4]-NNK enthielten. Dann wurden sie nach dem Zufallsprinzip einem von zwei Armen zugewiesen und erhielten entweder PEITC, gefolgt von Placebo, oder Placebo, gefolgt von PEITC. Während des einwöchigen Behandlungszeitraums nahm jede/r ProbandIn viermal täglich PEITC ein (10 mg in 1 ml Olivenöl). Zwischen der PEITC- und der Placebo-Periode gab es eine einwöchige Auswaschphase. Die metabolische Aktivierung von NNK wurde mittels Urinproben gemessen, damit verifiziert werden konnte, ob die PEITC-Behandlung in der Lage war, den NNK-Stoffwechsel zu verändern. Die Analyse zeigte, dass während der Behandlung mit PEITC das metabolische Aktivierungs-Verhältnis des Karzinogens um 7,7% reduziert wurde (p = 0,023). Die Ergebnisse dieser Studie, obgleich ihrer bescheidenen Effektgröße, können eine Grundlage für die weitere Untersuchung von PEITC als Hemmstoff der Lungenkarzinogenese und in der Prävention von NNK-induzierten Lungenkarzinomen bei RaucherInnen sein. [25]


