Mentha × odorata SOLE, Mentha × officinalis HULL, Mentha aquatica f. piperita (L.) G.MEY.
Definition der Droge
Menthae piperitae folium, die getrockneten ganzen oder geschnittenen Blätter von Mentha × piperita L.
Mit einem Gehalt an ätherischem Öl, der für die ganze Droge mindestens 12 ml/kg (wasserfreie Droge) und für die geschnittene Droge mindestens 9 ml/kg (wasserfreie Droge) aufweisen muss. [8]
Allgemeines
Die Minze-Arten zählen zu den bekanntesten Heilpflanzen der Welt, eine erste Beschreibung der Pfefferminze findet sich in der 3. Auflage des „Synopsis Stirpium Britannicarum“ (John Ray 1627 – 1705). Das x im botanischen Namen zeigt an, dass die Minze-Arten zur Bastardisierung neigen, so entstand auch die Pfefferminze aus einer Kreuzung aus Mentha aquatica x Mentha spicata, die in England gefunden oder gezüchtet wurde. Dementsprechend gibt es eine Vielzahl an verschiedenen Minze-Arten, wie zum Beispiel die Ackerminze (M. arvensis), die Poleiminze (M. pulegium L.) oder die Edelminze (M. gentilis), die vor allem in den Mittelmeerländern, aber auch in den oberen Rheinländern wachsen.
Der Name „Mentha“ entstand einem Mythos nach im antiken Griechenland. Persephone, die Gattin des Hades, riss aus Eifersucht die Geliebte ihres Mannes, die schöne Nymphe Minthe, in Stücke, woraufhin er in tiefer Trauer aus ihren Überresten eine stark duftende Pflanze wachsen ließ. Den Beinamen „piperita“ erhielt die Pfefferminze durch ihren pfefferartigen Geschmack.
Mittlerweile haben Fachgesellschaften, wie das Committee on Herbal Medicinal Products [1], die European Scientific Cooperative on Phytotherapy [2] und die World Health Organization [3] Monografien zur positiven Wirkung von Pfefferminzblätter und Pfefferminzöl veröffentlicht. Die getrockneten Blätter von Mentha piperita enthalten 0,5 – 4 % ätherisches Öl mit der Hauptkomponente L-Menthol. Pfefferminzblätter wirken appetitanregend, verdauungsfördernd und stimulierend auf Magensaft und Speichelproduktion, sowie karminativ, spasmolytisch und cholagog. Das Pfefferminzöl wird zudem bei Atemwegserkrankungen, sowie Spannungskopfschmerzen und Migräne eingesetzt.
Wegen seiner positiven Effekte bei Verdauungsbeschwerden wurde das Pfefferminzöl in letzter Zeit immer öfter für krampfartige Schmerzen im Verdauungstrakt, vor allem im Zusammenhang mit Colon irritabile (Reizdarmsyndrom), angewandt.
Das Reizdarmssyndrom oder oft kurz IBS für „irritable bowl syndrome“ ist eine Krankheit, die in ihrer Ausprägung besonders unangenehm ist, da sie große Auswirkungen auf alltägliche Aktivitäten und das soziale Gefüge der Betroffenen hat. Starke abdominelle Schmerzen, Stuhlunregelmäßigkeiten und die Inkonsistenz des Auftretens der Beschwerden lassen die Betroffenen oft rat- und hilflos zurück.
Das Ziel dieser Arbeit ist es, neben einem Überblick über die derzeitige Studienlage zu den vielfältigen Anwendungsgebieten der Pfefferminze, besonders auf die Wirkmechanismen des L-Menthols als Antagonist an Calcium-Kanälen der glatten Muskeln und Serotoninrezeptoren (5HT3) sowie als κ-Opioid-Agonist zur Behandlung des Reizdarmsyndroms einzugehen.
[4,5]
Die Pflanzenmonografie wurde mit freundlicher Genehmigung auf Basis der Diplomarbeit „Arzneipflanzenportraits ausgewählter Arzneidrogen“ (Mag. pharm. Antonia Kresnik) erstellt.
References
1. European Medicines Agency. Assessment report on Menthae x piperitae L., folium and aethereroleum. EMA/HMPC/522410/2013. Revision 1. 2020. Available from: https://www.ema.europa.eu/en/documents/herbal-monograph/european-union-herbal-monograph-mentha-x-piperita-l-aetheroleum-revision-1_en.pdf.
2. Menthae piperitae folium – Peppermint Leaf. The Scientific Foundation for Herbal Medicinal Products. Notaries House, Chapel Street, Exeter EX1 1EZ, United Kingdom; 2019.
3. World Health Organization. WHO monographs on selected medicinal plants. Volume 2. Geneva; 2002.
4. Bäumler S. Arzneipflanzenporträts. 2nd ed. München: Elsevier Urban & Fischer; 2012.
5. Scalera L. Focus on irritable bowel syndrome. European Review For Medical Pharmacological Sciences. 2012:1155–71. Available from: https://www.europeanreview.org/article/1355.
6. World Flora Online. Mentha × piperita L. World Flora Online. 2021 [updated 9 Jun 2021; cited 9 Jun 2021]. Available from: http://www.worldfloraonline.org/taxon/wfo-0000241184.
7. Rahfeld B. Mikroskopischer Farbatlas pflanzlicher Drogen. Berlin, Heidelberg: Springer Berlin Heidelberg; 2017.
8. Europäisches Arzneibuch 9. Ausgabe. Amtliche deutsche Ausgabe (Ph. Eur. 9.0). Stuttgart: Deutscher Apotheker Verlag; 2017.
9. Blaschek W, Wichtl M, Bauer R, Buff W, Classen B, Heise EM, et al., editors. Wichtl – Teedrogen und Phytopharmaka. Ein Handbuch für die Praxis. 6th ed. Stuttgart: WVG Wissenschaftliche Verlagsgesellschaft; 2016.
10. Sticher, Hellmann, Zündorf. Pharmakognosie – Phytopharmazie. 10th ed. Stuttgart: Wissenschaftliche Verlagsgesellschaft; 2015.
11. Oz M, El Nebrisi EG, Yang K-HS, Howarth FC, Al Kury LT. Cellular and Molecular Targets of Menthol Actions. Front Pharmacol. 2017; 8:472. Epub 2017/07/18. doi: 10.3389/fphar.2017.00472 PMID: 28769802.
12. Beigi M, Torki-Harchegani M, Ghasemi Pirbalouti A. Quantity and chemical composition of essential oil of peppermint ( Mentha × piperita L.) leaves under different drying methods. International Journal of Food Properties. 2018; 21:267–76. doi: 10.1080/10942912.2018.1453839.
13. Hurrell RF, Reddy M, Cook JD. Inhibition of non-haem iron absorption in man by polyphenolic-containing beverages. Br J Nutr. 1999; 81:289–95. doi: 10.1017/S0007114599000537.
14. Begas E, Tsioutsiouliti A, Kouvaras E, Haroutounian SA, Kasiotis KM, Kouretas D, et al. Effects of peppermint tea consumption on the activities of CYP1A2, CYP2A6, Xanthine Oxidase, N-acetyltranferase-2 and UDP-glucuronosyltransferases-1A1/1A6 in healthy volunteers. Food Chem Toxicol. 2017; 100:80–9. Epub 2016/12/21. doi: 10.1016/j.fct.2016.12.021 PMID: 28011360.
15. Gelal A, Jacob P, YU L, BENOWITZ N. Disposition kinetics and effects of menthol. Clinical Pharmacology & Therapeutics. 1999; 66:128–35. doi: 10.1053/cp.1999.v66.100455001.
16. Layer P, Andresen V, Pehl C, Allescher H, Bischoff S, Claßen M, et al. S3-Leitlinie Reizdarmsyndrom. Definition, Pathophysiologie, Diagnostik und Therapie. Gemeinsame Leitlinie der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). Zeitschrift Für Gastroenterologie. 2011; 49:237–93. doi: 10.1055/s-0029-1245976.
17. Brandt LJ, Chey WD, Foxx-Orenstein AE, Schiller LR, Schoenfeld PS, Spiegel BM, et al. An evidence-based position statement on the management of irritable bowel syndrome. The American journal of Gastroenterology. 2009; 104 Suppl 1. doi: 10.1038/ajg.2008.122 PMID: 19521341.
18. Grigoleit HG, Grigoleit P. Pharmacology and preclinical pharmacokinetics of peppermint oil. Phytomedicine. 2005; 12:612–6. doi: 10.1016/j.phymed.2004.10.007 PMID: 16121523.
19. Somerville KW, Richmond CR, Bell GD. Delayed release peppermint oil capsules (Colpermin) for the spastic colon syndrome: a pharmacokinetic study. Br J Clin Pharmacol. 1984; 18:638–40. doi: 10.1111/j.1365-2125.1984.tb02519.x PMID: 6487507.
20. Kearns GL, Chumpitazi BP, Abdel-Rahman SM, Garg U, Shulman RJ. Systemic exposure to menthol following administration of peppermint oil to paediatric patients. BMJ Open. 2015; 5:e008375. Epub 2015/08/12. doi: 10.1136/bmjopen-2015-008375 PMID: 26270949.
21. Miyazawa M, Marumoto S, Takahashi T, Nakahashi H, Haigou R, Nakanishi K. Metabolism of (+)- and (-)-menthols by CYP2A6 in human liver microsomes. J Oleo Sci. 2011; 60:127–32. doi: 10.5650/jos.60.127 PMID: 21343660.
22. Hiki N, Kaminishi M, Yasuda K, Uedo N, Kobari M, Sakai T, et al. Multicenter phase II randomized study evaluating dose-response of antiperistaltic effect of L-menthol sprayed onto the gastric mucosa for upper gastrointestinal endoscopy. Dig Endosc. 2012; 24:79–86. Epub 2011/06/01. doi: 10.1111/j.1443-1661.2011.01163.x PMID: 22348831.
23. Pan R, Tian Y, Gao R, Li H, Zhao X, Barrett JE, et al. Central mechanisms of menthol-induced analgesia. J Pharmacol Exp Ther. 2012; 343:661–72. Epub 2012/09/05. doi: 10.1124/jpet.112.196717 PMID: 22951274.
24. Gaudioso C, Hao J, Martin-Eauclaire M-F, Gabriac M, Delmas P. Menthol pain relief through cumulative inactivation of voltage-gated sodium channels. Pain. 2012; 153:473–84. Epub 2011/12/14. doi: 10.1016/j.pain.2011.11.014 PMID: 22172548.
25. Hall AC, Turcotte CM, Betts BA, Yeung W-Y, Agyeman AS, Burk LA. Modulation of human GABAA and glycine receptor currents by menthol and related monoterpenoids. European Journal of Pharmacology. 2004; 506:9–16. doi: 10.1016/j.ejphar.2004.10.026 PMID: 15588619.
26. Heimes, Hauk, Verspohl. Mode of Action of Peppermint Oil and (-)-Menthol with Respect to 5-HT3 Receptor Subtypes. Binding Studies, Cation Uptake by Receptor Channels and Contraction of Isolated Rat Ileum. Phytother Res. 2010; 25:702–8. doi: 10.1002/ptr.3316 PMID: 21077259.
27. Cheang WS, Lam MY, Wong WT, Tian XY, Lau CW, Zhu Z, et al. Menthol relaxes rat aortae, mesenteric and coronary arteries by inhibiting calcium influx. European Journal of Pharmacology. 2013; 702:79–84. Epub 2013/02/01. doi: 10.1016/j.ejphar.2013.01.028 PMID: 23380688.
28. Amato A, Liotta R, Mulè F. Effects of menthol on circular smooth muscle of human colon. Analysis of the mechanism of action. European Journal of Pharmacology. 2014a; 740. doi: 10.1016/j.ejphar.2014.07.018 PMID: 25046841.
29. Karashima Y, Damann N, Prenen J, Talavera K, Segal A, Voets T, et al. Bimodal action of menthol on the transient receptor potential channel TRPA1. J Neurosci. 2007; 27:9874–84. doi: 10.1523/JNEUROSCI.2221-07.2007 PMID: 17855602.
30. Liu B, Fan L, Balakrishna S, Sui A, Morris JB, Jordt S-E. TRPM8 is the principal mediator of menthol-induced analgesia of acute and inflammatory pain. Pain. 2013; 154:2169–77. Epub 2013/06/29. doi: 10.1016/j.pain.2013.06.043 PMID: 23820004.
31. Pergolizzi JV, Taylor R, LeQuang J-A, Raffa RB. The role and mechanism of action of menthol in topical analgesic products. J Clin Pharm Ther. 2018; 43:313–9. Epub 2018/03/10. doi: 10.1111/jcpt.12679 PMID: 29524352.
32. Amato A, Serio R, Mulè F. Involvement of cholinergic nicotinic receptors in the menthol-induced gastric relaxation. European Journal of Pharmacology. 2014b; 745:129–34. Epub 2014/10/16. doi: 10.1016/j.ejphar.2014.10.012 PMID: 25446932.
33. Juergens UR, Stöber M, Vetter H. The anti-inflammatory activity of L-menthol compared to mint oil in human monocytes in vitro. A novel perspective for its therapeutic use in inflammatory diseases. Eur J Med Res. 1998; 3:539–45.
34. Kamatou GPP, Vermaak I, Viljoen AM, Lawrence BM. Menthol: a simple monoterpene with remarkable biological properties. Phytochemistry. 2013; 96:15–25. Epub 2013/09/17. doi: 10.1016/j.phytochem.2013.08.005 PMID: 24054028.
35. Husain FM, Ahmad I, Khan MS, Ahmad E, Tahseen Q, Khan MS, et al. Sub-MICs of Mentha piperita essential oil and menthol inhibits AHL mediated quorum sensing and biofilm of Gram-negative bacteria. Front Microbiol. 2015; 6:420. Epub 2015/05/13. doi: 10.3389/fmicb.2015.00420 PMID: 26029178.
36. Ghodrati M, Farahpour MR, Hamishehkar H. Encapsulation of Peppermint essential oil in nanostructured lipid carriers. In-vitro antibacterial activity and accelerative effect on infected wound healing. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2019; 564:161–9. doi: 10.1016/j.colsurfa.2018.12.043.
37. Desam NR, Al-Rajab AJ, Sharma M, Mylabathula MM, Gowkanapalli RR, Albratty M. Chemical constituents, in vitro antibacterial and antifungal activity of Mentha×Piperita L. (peppermint) essential oils. Journal of King Saud University – Science. 2019; 31:528–33. doi: 10.1016/j.jksus.2017.07.013.
38. Sharafi SM, Rasooli I, Owlia P, Taghizadeh M, Astaneh SDA. Protective effects of bioactive phytochemicals from Mentha piperita with multiple health potentials. Pharmacogn Mag. 2010; 6:147–53. doi: 10.4103/0973-1296.66926 PMID: 20931070.
39. Chen L, Ma L, Yang S, Wu X, Dai X, Wang S, et al. A multiscale study of the penetration-enhancing mechanism of menthol. Journal of Traditional Chinese Medical Sciences. 2019; 6:347–54. doi: 10.1016/j.jtcms.2019.10.001.
40. Zhang X-B, Jiang P, Gong N, Hu X-L, Da Fei, Xiong Z-Q, et al. A-type GABA receptor as a central target of TRPM8 agonist menthol. PLoS One. 2008; 3:e3386. Epub 2008/10/13. doi: 10.1371/journal.pone.0003386 PMID: 18852885.
41. Galeotti N, Di Cesare Mannelli L, Mazzanti G, Bartolini A, Ghelardini C. Menthol. A natural analgesic compound. Neuroscience Letters. 2002; 322:145–8. doi: 10.1016/S0304-3940(01)02527-7.
42. Taher YA. Antinociceptive activity of Mentha piperita leaf aqueous extract in mice. Libyan J Med. 2012; 7. Epub 2012/03/27. doi: 10.3402/ljm.v7i0.16205 PMID: 22468149.
43. Ghasemi-Pirbaluti M, Motaghi E, Bozorgi H. The effect of menthol on acute experimental colitis in rats. European Journal of Pharmacology. 2017; 805:101–7. Epub 2017/03/18. doi: 10.1016/j.ejphar.2017.03.003 PMID: 28322843.
44. Mieriņa I, Jakaite L, Kristone S, Adere L, Jure M. Extracts of Peppermint, Chamomile and Lavender as Antioxidants. Key Engineering Materials. 2018; 762:31–5. doi: 10.4028/www.scientific.net/KEM.762.31.
45. Umezu T, Morita M. Evidence for the involvement of dopamine in ambulation promoted by menthol in mice. J Pharmacol Sci. 2003; 91:125–35. doi: 10.1254/jphs.91.125 PMID: 12686756.
46. Weerts ZZR, Masclee AA, Witteman BJ, Clemens CH, Winkens B, Brouwers JR, et al. Efficacy and Safety of Peppermint Oil in a Randomized, Double-Blind Trial of Patients With Irritable Bowel Syndrome. Gastroenterology. 2020; 158:123–36. doi: 10.1053/j.gastro.2019.08.026.
47. Cash BD, Epstein MS, Shah SM. A Novel Delivery System of Peppermint Oil Is an Effective Therapy for Irritable Bowel Syndrome Symptoms. Dig Dis Sci. 2016; 61:560–71. Epub 2015/08/29. doi: 10.1007/s10620-015-3858-7 PMID: 26319955.
48. Papathanasopoulos A, Rotondo A, Janssen P, Boesmans W, Farré R, Vanden BP, et al. Effect of acute peppermint oil administration on gastric sensorimotor function and nutrient tolerance in health. Neurogastroenterol Motil. 2013; 25. doi: 10.1111/nmo.12102 PMID: 23489975.
49. Alam MS, Roy PK, Miah AR, Mollick SH, Khan MR, Mahmud MC, et al. Efficacy of Peppermint oil in diarrhea predominant IBS – a double blind randomized placebo – controlled study. Mymensingh Med J. 2013; 22:27–30.
50. Merat S, Khalili S, Mostajabi P, Ghorbani A, Ansari R, Malekzadeh R. The effect of enteric-coated, delayed-release peppermint oil on irritable bowel syndrome. Dig Dis Sci. 2010; 55:1385–90. Epub 2009/06/09. doi: 10.1007/s10620-009-0854-9 PMID: 19507027.
51. Shavakhi A, Ardestani SK, Taki M, Goli M, Keshteli AH. Premedication with peppermint oil capsules in colonoscopy: a double blind placebo-controlled randomized trial study. Acta Gastroenterol Belg. 2012; 75:349–53.
52. Inoue K, Dohi O, Gen Y, Jo M, Mazaki T, Tokita K, et al. L-menthol improves adenoma detection rate during colonoscopy: a randomized trial. Endoscopy. 2014; 46:196–202. Epub 2014/02/26. doi: 10.1055/s-0034-1365035 PMID: 24573731.
53. Shah I, Baffy NJ, Horsley-Silva JL, Langlais BT, Ruff KC. Peppermint Oil to Improve Visualization in Screening Colonoscopy. A Randomized Controlled Clinical Trial. Gastroenterology Research. 2019; 12. doi: 10.14740/gr1180 PMID: 31236155.
54. Fallon MT, Storey DJ, Krishan A, Weir CJ, Mitchell R, Fleetwood-Walker SM, et al. Cancer treatment-related neuropathic pain: proof of concept study with menthol–a TRPM8 agonist. Support Care Cancer. 2015; 23:2769–77. Epub 2015/02/15. doi: 10.1007/s00520-015-2642-8 PMID: 25680765.
55. Göbel H, Heinze A, Heinze-Kuhn K, Göbel A, Göbel C. Oleum menthae piperitae (Pfefferminzöl) in der Akuttherapie des Kopfschmerzes vom Spannungstyp. Schmerz. 2016; 30:295–310. doi: 10.1007/s00482-016-0109-6 PMID: 27106030.
56. Borhani Haghighi A, Motazedian S, Rezaii R, Mohammadi F, Salarian L, Pourmokhtari M, et al. Cutaneous application of menthol 10% solution as an abortive treatment of migraine without aura. A randomised, double-blind, placebo-controlled, crossed-over study. Int J Clin Pract. 2010; 64:451–6. doi: 10.1111/j.1742-1241.2009.02215.x PMID: 20456191.
57. Rafieian-Kopaei M, Hasanpour-Dehkordi A, Lorigooini Z, Deris F, Solati K, Mahdiyeh F. Comparing the Effect of Intranasal Lidocaine 4% with Peppermint Essential Oil Drop 1.5% on Migraine Attacks. A Double-Blind Clinical Trial. Int J Prev Med. 2019; 10:121. Epub 2019/07/05. doi: 10.4103/ijpvm.IJPVM_530_17 PMID: 31404204.
58. Masoumi SZ, Asl HR, Poorolajal J, Panah MH, Oliaei SR. Evaluation of mint efficacy regarding dysmenorrhea in comparison with mefenamic acid. A double blinded randomized crossover study. Iran J Nurs Midwifery Res. 2016; 21:363–7. doi: 10.4103/1735-9066.185574 PMID: 27563318.
59. Asgarshirazi M, Shariat M, Dalili H. Comparison of the Effects of pH-Dependent Peppermint Oil and Synbiotic Lactol (Bacillus coagulans + Fructooligosaccharides) on Childhood Functional Abdominal Pain. A Randomized Placebo-Controlled Study. Iranian Red Crescent Medical Journal. 2015; 17:195. doi: 10.5812/ircmj.17(4)2015.23844.

Ihren Namen gab der Pfefferminze der Schwede Carl von Linné (1707-1778), sie ist ein Hybrid aus der Bachminze Mentha aquatica L. und der Grünen Minze Mentha spicata L. Genauer gesagt handelt sich bei der Pfefferminze sogar um einen so genannten Triplebastard, da die Mentha spicata L. ihrerseits ebenfalls aus einer Kreuzung der Arten Mentha longifolia (L.) HUDS. und Mentha rotundifolia (L.) HUDS entstanden ist. [9]
Die Pfefferminzpflanze ist ein mehrjähriges, 30 – 90 cm hohes Kraut. Ihr ausgeprägter vierkantigen Stängel ist aufrecht, aufsteigend oder verzweigt, meist kahl oder graufilzig bedeckt. Die Blätter wachsen kreuzweise gegenständig, gestielt, länglich-eiförmig bis länglich-lanzettlich und sind am Rand gesägt und spitz. Die Blattoberseite ist dunkelgrün, auf der Blattunterseite sind neben der violetten Nervatur, Drüsenschuppen als kleine gelbe Punkte erkennbar. Die violetten Blüten treten in dichten, endständigen, ährenartigen Trauben aus Scheinquirlen auf. Jede Blüte hat einen röhrenförmigen Kelch mit 5 scharfen, behaarten Zähnen, einen purpurne, unregelmäßige, 4-blättrige Blumenkrone, 4 kurze Staubblätter, einen 4-zelligen Fruchtknoten und einen abstehenden Griffel, der in einer zweigeteilten Narbe endet. Die Frucht besteht aus 4 ellipsoiden Nüsschen. [3]
Durch Kreuzung und Selektion entstanden im Laufe der Zeit mehrere Pfefferminze-Varietäten. Am häufigsten kultiviert wurde die Sorte „Mitcham“ oder „black mint“, da sie ertragreicher war und einen höheren Gehalt an ätherischen Ölen als ihre genetischen Vorfahren aufwies. Sie ist erkennbar an ihren dunkelgrünen Blättern und trägt den offiziellen Namen Mentha x piperita L. f. rubescens CAMUS. Die so genannten „white mint“-Varietäten Mentha x piperita L. f. pallescens CAMUS haben hellgrüne, lanzettliche Blätter. Sie sind weniger robust und bevorzugen wärmere Lagen. [9]
Bevorzugt wächst die Pfefferminzpflanze im Juni und Juli an sonnigen Standorten auf nährstoffreichen, feuchten Böden, wobei sie auch halbschattige Plätze gut verträgt. [4]
Droge
Bei der Droge Menthae piperitae folium handelt es sich um die getrockneten, geschnittenen oder ganzen Blätter von Mentha x piperita, wobei die ganzen Blätter nicht weniger als 12 ml/kg des ätherischen Öles enthalten dürfen und die geschnittenen nicht weniger als 9 ml/kg. [2]. Die Blätter werden kurz vor der Blüte von Juni bis September geerntet, die größten Anbaugebiete für Pfefferminze sind die Ukraine, die Balkanländer, Griechenland, Deutschland, Österreich und Spanien. [4]
Menthae piperitae folium sind 3 bis 9 cm lang, 1 bis 3 cm breit, grün bis bräunlich grün und lanzettlich zugespitzt. Erkennungsmerkmale sind die violette Netznervatur und die gelben Drüsenhaare an der Blattunterseite. [7]
Pfefferminzblätter können als Tee zubereitet werden, hierfür werden 1,5 g der Droge mit kochendem Wasser übergossen und 5 – 10 min bedeckt stehen gelassen. Auf diese Weise verbleiben circa 20 – 25 % des ätherischen Öles im Teeaufguss. [9]
Das ätherische Öl der Pfefferminze, Oleum menthae piperitae, wird vor allem in den USA, Bulgarien, Italien, Frankreich und Marokko hergestellt. Es handelt sich dabei um das aus Wasserdampfdestillation gewonnene Öl der frischen oberirdischen Teile von Mentha x piperita. Das farblose oder blassgelbe bis blass-grünlich gelbe Öl hat einen charakteristisch aromatischen Geschmack und Geruch, gefolgt von einer kühlen Empfindung. Der Hauptbestandteil und die wirkungsbestimmende Komponente des Öles ist, mit 35 – 55 %, das Menthol, außerdem enthalten sind Menthon, Menthylacetat, Lamiaceen-Gerbstoffe und Flavonoide. Zur Inhalation können 3 – 4 Tropfen des Öles zu heißem Wasser gegeben und anschließend eingeatmet werden. Es existieren zudem verschiedene Pfefferminzextrakte in Form unterschiedlicher Phytopharmaka, die mit Ethanol oder Wasser hergestellt werden und in flüssiger oder fest verpresster Form eingenommen werden können.
Der Pulegon-Gehalt der Droge darf laut Europäischem Arzneibuch (9. Ausgabe) bei höchstens 3 %, der Carvon-Gehalt nur bei 1 % liegen. Das Verhältnis des 1,8-Cineol-Gehalts zum Limonen-Gehalt muss mindestens 2 betragen. [8]
Verfälschungen der Droge sind selten, da die Pfefferminze häufig kultiviert wird, die japanische Minze (Mentha arvensis var. piperascens (MALINV.) ex HOLMES) wurde auf Märkten teilweise untergemischt. Auf Grund ihrer ähnlichen morphologischen und anatomischen Merkmale kann dies ohne zu Hilfenahme eines DC-Nachweises des Menthofurans, das in der japanischen Minze nicht enthalten ist, aber nicht erkannt werden. Ein zu hoher Anteil an Stängeln (über 5 %) kann häufiger vorkommen und die Qualität mindern, höchstens 8 % der Blätter sollten durch Minzenrost (Puccinia menthae) braun gefleckt sein. [7,9]
Im Handel werden die ätherischen Öle der Pfefferminze nach Herkunftsgebieten wie beispielweise englisches (Mitcham), italienisches (Italo-Mitcham) und amerikanisches Pfefferminzöl unterschieden. Es ist schwierig, Verfälschungen durch chromatographische Verfahren nachzuweisen, da beispielsweise die Zugabe von synthetischem Menthofuran, rac-Menthylacetat oder rektifizierten Minzölen einen ähnlichen Fingerprint ergeben wie genuines Pfefferminzöl. Der Identitätsnachweis kann durch Darstellung der Enantiomeren-Verhältnisse der chiralen Inhaltsstoffe über eine enantioselektive multidimensionale Gaschromatographie oder Bestimmung des Isotopenfingerprints erbracht werden. Am besten bestimmbar ist die Qualität des Pfefferminzöles über den Methylacetat-Gehalt, da nur im genuinen Öl enantiomerenreines (-)-(1R, 3R, 4S)-Methylacetat nachweisbar ist. [10]
In der Ganzdroge müssen mindestens 1,2 %, in der geschnittenen Droge 0,9 % des ätherischen Öls enthalten sein. Die Bestandteile des ätherischen Öles sind laut europäischem Arzneibuch (9.Auflage) wie folgt:
– Limonen: 1,0 bis 3,5 %
– 1,8-Cineol: 3,5 bis 8,0 %
– Menthon: 14,0 bis 32,0 %
– Menthofuran: 1,0 bis 8,0 %
– Isomenthon: 1,5 bis 10,0 %
– Menthylacetat: 2,8 bis 10,0 %
– Isopulegol: höchstens 0,2 %
– L-Menthol: 30,0 bis 55,0 %
– Pulegon: höchstens 3,0 %
– Carvon: höchstens 1,0 %
[8]
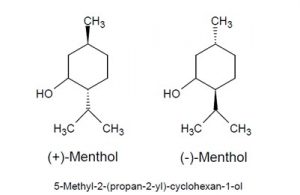 Abbildung: Der Hauptbestandteil des Pfefferminzöls ist das Menthol. (Eigene Formelzeichnung)
Abbildung: Der Hauptbestandteil des Pfefferminzöls ist das Menthol. (Eigene Formelzeichnung)
Hinzu kommen noch geringe Mengen an Mono- und Sesquiterpenen, sowie 3,5 bis 4,5 % Lamiaceengerbstoffe (vor allem Phenolcarbonsäuren wie die Rosmarinsäure und andere Kaffeesäurederivate) und 3,0 bis 6,3 % Flavonoide mit deren Hauptrepräsentant Eriocitrin, außerdem Luteolin-7-rutinosid, Hesperidin, Diosmin, Isorhoifolin, Narirutin, Naringenin-7-O-glucosid, Luteolin-7-O-glucuronid, Luteolin und Naringenin. [4,9]
Der Hauptinhaltsstoff von Mentha x piperita ist demnach das L-Menthol ([(1R,2S,5R)-5-Methyl-2-(propan-2-yl)-cyclohexan-1-ol] IUPAC).
Menthol ist eine Verbindung mit drei asymmetrischen Kohlenstoffatomen (Molare Masse: 156,27 g/mol) und existiert auf Grund dessen in vier optischen Isomeren. Die häufigste Form ist das (-)-Menthol (L-Menthol), des Weiteren gibt es (+)-Menthol, (-)-Isomenthol, (+)-Isomenthol, (-)-Neomenthol, (+)-Neomenthol und (-)-Neoisomenthol und (+)-Neoisomenthol. [11]
Die chemische Zusammensetzung des Pfefferminzöles wurde in zahlreichen Publikationen untersucht. Die unterschiedlichen in der Literatur berichteten Ergebnissen der chemischen Bestandteile der Pfefferminze können auf unterschiedliche geografische Herkunft der Pflanzen, den Erntezeitpunkt sowie auf die Extraktionsmethode zurückgeführt werden.
Beigi et al. verglichen die extrahierten ätherischen Öle aus den frischen und getrockneten Pfefferminzblättern mittels GC/MS-Analyse. In frischen Pfefferminzblättern identifizierten sie insgesamt 36 Komponenten, die 93,84 % der gesamten flüchtigen Bestandteile ausmachten. In den frischen Proben waren die Hauptkomponenten Menthol (44,39 %), Menthon (15,36 %), Menthofuran (10,27 %), 1,8-Cineol (5,81 %), Menthylacetat (4,78 %), Neoisomenthol (2,37 %) und Limonen (1,87 %). Außerdem wurde gezeigt, dass die Trocknungsmethode eine signifikante Auswirkung auf das chemische Profil des ätherischen Öles hatte. Heißluft (bei 50°C, 60°C und 70°C) und Mikrowellentrocknung führten zu geringen Verlusten der flüchtigen Verbindungen im Vergleich zu frischen Blättern. Darüber hinaus verbesserte die Mikrowellenmethode in einigen Fällen die Ausbeute einiger bioaktiver Verbindungen, wie beispielsweise Menthol und Menthylacetat. [12]
Die Minze-Arten gehören zu den ältesten Arzneipflanzen der Welt und spielten bereits im Altertum eine wichtige Rolle. Zwischen 1200 und 600 v. Chr. wurden sie in ägyptischen Gräbern als Beigaben verwendet. Aus Minze, Wasser und Gerste bestand auch der heilige Trank, den man im alten Griechenland bei eleusinischen Festen zu Ehren der Demeter zubereitete. Symbolisierten Minzeblätter früher leidenschaftliche Liebe, sind sie heute eher als Glücksbringer bekannt. So wurden sie in katholischen Gegenden als Bestandteil des sogenannten Würzbüschels zu Mariä Himmelfahrt geweiht und in der Wohnstube oder im Stall platziert.
Für medizinische Zwecke setzte Dioskurides den Samen der Pfefferminze mit Wein getrunken gegen Blasenleiden und Schluckauf ein. Bei Kopfschmerzen und Insektenstichen legte man Blätter auf die betroffenen Stellen und bei Übelkeit wurde ein Pfefferminztee zubereitet.
Hildegard von Bingen nutzte unterschiedliche Minze-Arten, die Bachminze bei Magenproblemen und gegen Erkältungen, die Ackerminze bei Augengeschwüren und Verdauungsbeschwerden und die Rossminze nur zur äußerlichen Anwendung.
Am häufigsten beschrieben ist die Minze aber als Stomachikum und Karminativum. [4]
Pfefferminzblätter sind vor allem bekannt für ihre spasmolytischen, antimikrobiellen, karminativen, choleretischen Wirkungen auf das Verdauungssystem. Nützlich sind die verschiedenen Darreichungsformen der Pflanze aber auch zur Linderung von Kopfschmerzen oder gegen erkältungsbedingte Beschwerden.
Die Indikationsgebiete zu verschiedenen Darreichungsformen der Pfefferminzpflanze wurden unter anderen vom European Medicines Agency Commitee on Herbal Medicinal Products (EMA), European Scientific Cooperative on Phytotherapy (ESCOP) und der World Health Organization (WHO) überprüft und festgelegt.
Getrocknete Pfefferminzblätter als Tee oder in Form von Tinkturen können, oral verabreicht, gegen Dyspepsien, Blähungen, intestinale Koliken, Spasmen des Magen-Darm-Traktes und Gallenstörungen eingesetzt werden.
Seit 1982 gibt es in Deutschland eine Standardzulassung für die orale Gabe von Pfefferminzöl zur Behandlung von leichten Krämpfen des Gastrointestinaltrakts und der Gallengänge, zur Symptomlinderung bei Husten und Erkältungskrankheiten und bei Entzündungen der oralen Schleimhaut. Zur Abhilfe gegen Husten und Schnupfen kann das Öl auch inhaliert oder kutan angewendet werden. Transdermal ist es ebenso zugelassen zur Behandlung neuralgischer oder Muskelschmerzen. 1983 wurde die Zulassung um die Behandlung von Symptomen des Reizdarmssyndroms (RDS), abdomineller Schmerzen, Blähungen, Völlegefühl, Verstopfung und Durchfall erweitert. [1]
In Österreich galt die Zulassung von Pfefferminzöl gegen RDS für Erwachsenen und Jugendliche seit 1986, seit 2005 ist die Anwendung auch für Kinder zwischen 8 und 12 Jahren indiziert. [1]
Auch die ESCOP und die WHO führen unter, durch klinische Daten unterstützter, innerlicher medizinischer Verwendung von Pfefferminzöl die Symptombehandlung von RDS, Verdauungsbeschwerden, Blähungen und Gastritis an. Äußerlich kann es bei Myalgien, Kopfschmerzen, Husten und rheumatischen Beschwerden angewendet werden. Die orale Gabe des ätherischen Öls bei Husten und Katharren der Atemwege schließt die WHO nur unter traditioneller Verwendung ein. [2,3]
Die größten Verwerter von Pfefferminzöl sind die Kosmetik- und Lebensmittelindustrie, dort wird es hauptsächlich als Geruchs- und Geschmackskorrigens eingesetzt. Vor allem in Mundwässern, Zahnpasten und Gurgellösungen ist das Pfefferminzöl wegen seines erfrischenden Menthol Geschmacks beliebt. In Lebensmitteln findet es in Kaugummis, Süßwaren und Likören Anwendung. Auch in der pharmazeutischen Industrie wird es zur Geschmacksmaskierung vieler Pulver oder Lösungen sowie für Lutschtabletten verwendet.
Zur reinen Menthol-Gewinnung wird jedoch ein anderes Minzöl verwendet, nämlich das der Japanischen Minze Mentha arvensis var. piperascens, da es wesentlich kostengünstiger ist. Geruchlich und geschmacklich ähneln sich das Pfefferminz- und das Japanische Minzöl zwar, doch das etwas bitterere, in seiner Gesamtheit oft als weniger harmonisch empfundene, Japanische Minzöl ist wesentlich unbeliebter. [10]
Pfefferminzblätter:
ESCOP: Als Infus, 1,5 – 3 g mit 150 ml heißem Wasser übergossen, dreimal täglich.
Kinder zwischen 4 und 10 Jahren 3 – 5 g einmal täglich.
Kinder zwischen 10 und 16 Jahren 3 – 6 g einmal täglich.
EMA: Als Infus, 1,5 – 3 g mit 100 – 150 ml heißem Wasser übergossen, dreimal täglich.
Tagesdosis Erwachsene: 3 – 9 g.
Tagesdosis Kinder (4 – 11 Jahre): 3 – 6 g.
Tinktur:
ESCOP: 1:5; 45 % Ethanol, dreimal täglich
EMA: 1:5; 45 % Ethanol (V/V) oder 1;5; Ethanol 70 % (V/V), 6 – 9 ml dreimal täglich.
Pfefferminzöl:
WHO: 0,2 – 0,4 ml, dreimal täglich.
Zum Inhalieren 3 – 4 Tropfen in heißem Wasser.
Als Lutschtablette 2 – 10 mg des ätherischen Öles.
Äußerlich 5 – 20 % des Öls in verdünnter, halbfester oder öliger Form.
5 – 10 % in Ethanol-Wasser-Gemischen.
1 – 5 % in Nasensalben.
ESCOP: 0,02 – 0,08 ml (1 – 4 Tropfen) bis zu dreimal täglich bei Verdauungsbeschwerden.
0,2 – 0,4 ml in magensaftresistenter Kapselform dreimal täglich bei RDS.
Kinder zwischen 4 und 16 Jahren bei Verdauungsbeschwerden Anteil der Erwachsenendosis nach Körpergewicht.
Zum Inhalieren 3 – 4 Tropfen in heißem Wasser.
Äußerlich In verdünnter flüssiger oder halbfester Form (Äquivalent 0,1 – 1,0 % Menthol (m/m)) zur Betäubung und gegen Juckreiz.
1,25 – 16 % Menthol (m/m) als Gegenreizmittel oder gegen Schmerzen.
Gegen Spannungskopfschmerzen als 10 % Lösung.
Kinder zwischen 4 und 10 Jahren 2 – 10 % in halbfester und 2 – 4 % in wässrig-ethanolischer Form.
Kinder zwischen 10 und 16 Jahren 5 – 15 % in halbfester und 3 – 6 % in wässrig-ethanolischer Form.
EMA: In Österreich 187 mg ätherisches Öl in magensaftresistenter Form dreimal täglich.
Kinder zwischen 8 und 12 Jahren bis zu drei Kapseln täglich.
In Deutschland 182 mg ätherisches Öl in magensaftresistenter Form dreimal täglich. (Keine Zulassung für Kinder)
Zum Inhalieren 3 – 4 Tropfen in heißem Wasser.
Äußerlich Hydroethanolische Lösungen 5 – 10 % bis zu dreimal täglich.
[1–3]
Unerwünschte Wirkungen
Von Pfefferminzblättern sind grundsätzlich keine Nebenwirkungen bekannt, bei magenempfindlichen Personen sind Magenbeschwerden möglich, vor allem bei täglicher Konsumation von Pfefferminztee. [9]
Eine Studiengruppe zeigte, dass verschiedene polyphenolhaltige Tees, unter anderem Pfefferminztee, die Aufnahme von Nicht-Hämeisen reduzieren können. 3 g Pfefferminzblätter (Menthae piperitae folium) zubereitet als Infus (300 ml kochendes Wasser), hemmten durch ihren hohen Gehalt an Polyphenolen die Eisenaufnahme um 84 %. [13]
Pfefferminzöl kann, wenn es in nicht-magensaftresistenter Form appliziert wird, teilweise zu Sodbrennen führen, besonders bei Personen mit einer Refluxösophagitis.
Bei Überdosierung können gastrointestinale Beschwerden, Diarrhoe, rektale Ulzerationen und interstitielle Nephritis auftreten. Es können zentralnervöse Störungen sowie epileptische Anfälle ausgelöst werden. [4]
Die letale Dosis wird beim Menschen auf 2 – 9 g des ätherischen Öles geschätzt.
Bei überdosierten Zubereitungen mit Menthol Konzentrationen über 10 % kann es zu einer Erhöhung der Schmerzempfindlichkeit kommen. [4]
Äußerlich kann es in seltenen Fällen zu Hautirritationen kommen. Die Inhalation von Menthol kann bei Menschen mit Prädispositionen zu Atembeschwerden und Kehlkopfverengungen führen. Bei Überdosierung durch exzessive Inhalation können Schwindel, Anorexie, Herzbeschwerden, Ataxie und andere zentralnervöse Störungen auftreten. [2,3]
Gegenanzeigen/Anwendungsbeschränkungen
Pfefferminzblätter und ihr ätherisches Öl sollten bei Gallensteinen, Verschluss der Gallenwege, Gallenblasenentzündungen und Leberschäden nicht angewendet werden. Bei der äußerlichen Anwendung sollte darauf geachtet werden, das Öl nicht direkt auf Schleimhäute oder verletzte Haut aufzutragen. [3,9]
Für Personen, die sensibel auf Pfefferminzöl oder Menthol reagieren, ist die Anwendung kontraindiziert. [2]
Bei Säuglingen und Kleinkindern darf Pfefferminzöl besonders im Bereich des Gesichts und der Nase, wegen erhöhter Gefahr eines Kratschmer-Reflexes mit Glottisödem und Atemdepression, nicht angewendet werden. [4]
Wechselwirkungen
Für Pfefferminzöl in oral applizierbaren Arzneiformen gibt es in der Literatur keine Daten zu pharmakodynamischen Interaktionen. Generell werden Pfefferminzöl und seine Hauptkomponente, das Menthol, nach Evaluierung aller relevanten Sicherheitsdaten als sicher und gut verträglich eingestuft.
Pfefferminztee:
Sechs Tage langes Trinken von Pfefferminztee reduzierte die Aktivität der N-Acetyltransferase NAT2, die die Detoxifizierung von Arzneistoffen und Xenobiotika durch Acetylierung katalysiert. Die Cytochrom P450 1A2 (CYP1A2) Aktivität wurde ebenfalls reduziert, jedoch nicht signifikant. Die In-vivo-Aktivität der Xenobiotika-metabolisierenden Enzyme CYP2A6, Xanthinoxidase (XO) und UDP-Glycosyltransferasen (UGT1A1/1A6) blieb unverändert. Der signifikante Effekt von Pfefferminztee auf die NAT2-Aktivität könnte die Elimination verschiedener klinisch verwendeter Medikamente wie Aminoglutethimid, Amrinon, Clonazepam, Nitrazepam, Dapson, Hydralazin, Isoniazid, Sulfasalazin u.a. beeinflussen. Außerdem könnte es durch reduzierte O-Acetylierung von Prokarzinogenen durch NAT2 zu chemopräventiven Effekten kommen. [14]
Pfefferminzöl:
In einer placebokontrollierten Crossover-Studie wurde drei Tage lang die Kinetik von Menthol an 12 Testpersonen untersucht. Jeder erhielt 100 mg L-Menthol oder das Placebo und zusätzlich 10 mg Menthol in Form eines Minzbonbons oder ähnlichem, um die unkontrollierte Menthol Zufuhr aus der Nahrung zu simulieren.
Menthol wurde rasch metabolisiert und nur Mentholglucuronid konnte in Plasma und Urin gemessen werden. Die Plasma Halbwertszeit von Mentholglucuronid betrug circa 56.2 min (95 % CI, 51,0 – 61,5) und 42,6 min (95 % CI, 32,5 – 52,7) für Menthol Kapseln oder Bonbons (p < 0,05). Das Konzentrations-Zeit-Kurven Verhältnis von Menthol Kapseln zu Minzbonbons lag durchschnittlich bei 9,2 (95 % CI, 8,2 – 10,1). [15]
Pulegon Menthofuran
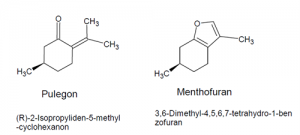
Abbildung: Strukturen von Pulegon und dessen Metabolit Menthofuran.
(Eigene Formelzeichnung)
Unter den Bestandteilen des Pfefferminzöls von Mentha x piperita befinden sich auch das Monoterpen Pulegon und dessen Metabolit Menthofuran, die im Tierversuch hepatotoxische Aktivität zeigten. Die beiden Inhaltsstoffe wurden daher vom HMPC auf ihre Toxizität evaluiert.
Das Komitee kam zu dem Schluss, dass die lebenslange orale Einnahme von 37,5 mg Pulegon und Menthofuran täglich, für Personen mit 50 kg Körpergewicht, als unbedenklich eingestuft werden kann. Bei einer Einnahmedauer von unter einem Jahr können bis zu 75,0 mg täglich eingenommen werden. Die höchste empfohlene tägliche Dosis von Pfefferminzöl liegt bei 1,2 ml, das ist 1122 mg mit maximal 37,03 mg enthaltenem Pulegon und Menthofuran.
Für Kinder mit circa 20 kg Körpergewicht, sind 15 mg pro Tag oder 30 mg pro Tag für den Zeitraum von unter einem Jahr akzeptabel. [1]
Pharmakokinetik
Studien an Ratten und begrenzte Daten am Menschen zeigten, dass Pfefferminzöl schnell resorbiert wird. [18] Bei einer Darreichung in Kapselform, die für eine verzögerte Freisetzung ausgelegt ist, erreichen aber nur etwa 70 % den Dickdarm. [19]
Bei gesunden Erwachsenen führte eine orale Dosis von 100 mg Menthol zu einer durchschnittlichen Spitzenblutkonzentration von 16,7 ± 5,5 μmol/l und einer scheinbaren Eliminationszeit t1/2 von 56 ± 8 min. [15]
Menthol wird hauptsächlich in der Leber über Cytochrom P450-Enzyme und über Uridindiphosphat-Glucuronosyltransferasen (UDP-GT) zu Mentholglucuronid transformiert und über die Galle ausgeschieden. [20]
Da die Clearance unter anderem über CYP2A6 Enzyme erfolgt, besteht das Risiko, dass genetische Polymorphismen und andere Substanzen, die die CYP2A6-Aktivität beeinflussen, die Konzentrations-Zeit-Kurve von Pfefferminzöl verändern könnten. [21] Nach der biliären Ausscheidung geht Mentholglucuronid in den enterohepatischen Kreislauf über. Pfefferminzöl-Metaboliten werden im Urin zum Teil als Glucuronsäurekonjugate ausgeschieden, wobei ≥ 50 % einer oralen Dosis von 100 mg Menthol im Urin als Mentholglucuronid vorliegen. [15,22]
In-vitro-Studien
Analgetische und Spasmolytische Wirkungen durch Ionenkanalmodulation
Der analgetische Effekt beruht teilweise auf der Inhibition spannungsabhängiger Natriumkanäle in neuronalen Zellen und Skelettmuskelfasern durch Menthol. Menthol hemmte in zwei In-vitro-Studien dosisabhängig spannungsabhängige Natriumkanäle in Neuronen des Dorsalwurzelganglions. Zugaben von 125 µM bis 1 mM Menthol führten zu einer leicht steigenden Hemmung des Natriumstroms, wenn die Zellen im Ruhezustand gehalten wurden (-100 mV), aber zu einer deutlich höheren Hemmung, wenn die Zellen inaktiv waren (-55 mV). Dies deutet auf einen Effekt hin, der sowohl von der Dosis als auch dem Aktivierungs-Zustand der Natriumkanäle abhängig ist. [23,24]
(-)-Menthol, Menthon und andere ihrer Derivate modulieren stereoselektiv ionotrope GABAA– und Glycin-Rezeptoren. GABAA– und Glycin-Rezeptoren sind die wichtigsten ionotropen Rezeptoren, die für die schnelle inhibitorische Neurotransmission im gesamten Nervensystem der Säugetiere verantwortlich sind. Eine positive Modulation dieser Rezeptoren führt oft zu Sedierung und Anästhesie. Besonders Menthol ist ein potenter und stereoselektiver allosterischer Modulator von GABAA-Rezeptoren. In Konzentrationen von 10 – 100 µM zeigten sowohl (-)-Menthol als auch (+)-Menthol starke positive Modulation der GABA-Ströme, wobei (+)-Menthol den größeren Effekt erzielte. [25]
Die Wirkung von Menthol auf 5-HT3-Rezeptoren wurde unter Verwendung von drei verschiedenen In-vitro-Modellen getestet. Pfefferminzöl und sein Hauptbestandteil (-)-Menthol hemmten konzentrationsabhängig den Einstrom radioaktiv markierter Kationen durch 5-HT3-Rezeptor-Kanäle, wobei (-)-Menthol etwa für die Hälfte der Wirkung des ätherischen Öls verantwortlich war. Sowohl das ätherische Öl als auch (-)-Menthol reduzierten die Serotonin-induzierte Kontraktion des Rattenileums und zeigten dadurch direkte relaxierende Effekte. Die Wirkung des ätherischen Öls wird nur teilweise durch (-)-Menthol vermittelt, zusätzlich sind weitere Komponenten an der Gesamtwirkung von Pfefferminzöl beteiligt. [26]
Ausschlaggebend für die Wirksamkeit des Pfefferminzöls ist außerdem der krampflösende Effekt. Menthol führte zu verminderter Kontraktion der vaskulären glatten Muskulatur (Koronararterien und Aorta in Ratten), durch Verringerung des Ca2+-Einstroms über Dihydropyridin-sensitive L-Typ Calciumkanäle. [27] Dieser spasmolytische Effekt konnte auch an der glatten Muskulatur des menschlichen Dickdarms gezeigt werden. Menthol (0,1 – 30 mM) verminderte durch Hemmung des Calciumeinstroms die Kontraktilität des Dickdarm-Rundmuskels. [28]
Eine weitere Familie der, unter anderem auch durch Calcium aktivierten, Ionenkanäle sind die Transient Receptor Potential Channels (TRP). TRPA1 ist ein hochempfindlicher Menthol-Rezeptor, der nach topischer Menthol-Anwendung sehr wahrscheinlich zu den vielfältigen psychophysischen Empfindungen wie Kälte auf der Haut oder den Schleimhäuten der Mund- und Nasenhöhle beiträgt. [29] TRPM8 ist dagegen der Hauptmediator der Menthol-induzierten Analgesie akuter und entzündlicher Schmerzen. [30]
Daher schlossen auch die AutorInnen eines Reviews darauf, dass Menthol durch seine Wirkung als selektiver Aktivator der Transient-Receptor-Potential-Melastatin-8-Kanäle (TRPM8) und vasoaktive Verbindung analgetisch wirkt, indem es einen kühlenden Effekt vermittelt und Nozizeptoren zunächst stimuliert und dann desensibilisiert. Topisch angewendetes Menthol kann auch zentrale analgetische Bahnen aktivieren. In hohen Konzentrationen kann Menthol außerdem Kälte-Allodynie erzeugen. [31]
Ein anderes Ziel des Menthols sind die nikotinergen Acetylcholin-Rezeptoren (nACh), die vermutlich zur Relaxation des Magentonus bei Mäusen beitragen. Ein Beleg hierfür konnte durch die Zugabe eines Nikotinrezeptorantagonisten (Hexamethonium) geliefert werden. Die durch Menthol ausgelöste Relaxation war nach Zugabe des Antagonisten signifikant vermindert. Weiters minderte Menthol, in Konzentrationen, die den Magentonus nicht beeinflussten, die durch DMPP (nACh-Rezeptor Agonist Dimethylphenylpiperazinium) verursachte Kontraktion. Die gleichzeitige Anwendung von Hexamethonium mit Phentholamin oder Atropin (α-Rezeptor-Antagonist und Muskarinrezeptor-Antagonist) führte zu keiner additiven Verminderung der Menthol-induzierten Entspannung. Die AutorInnen schlussfolgerten, dass die Interaktion zwischen dem nACh-Rezeptor und Menthol wahrscheinlich ein wichtiger Bestandteil der Menthol-induzierten Relaxation des Magenmuskels ist. [32]
Entzündungshemmung
In vitro unterdrückte Menthol die Produktion von Entzündungsmediatoren aus menschlichen Monozyten. [33]
Antimikrobielle/antimykotische Wirkung
Mehrere Studien haben gezeigt, dass das in Pfefferminzöl enthaltene Menthol eines der stärksten antimikrobiellen, antimykotischen und antiviralen Terpene ist. [34] Es wirkt bakterizid gegen mindestens 20 häufige Darmpathogene und ist in der Lage, die Quorum-Sensing-Aktivität gramnegativer Erreger zu hemmen. [35]
In einer Studie wurde die Effizienz von Pfefferminzöl (PEO), das in Nanolipid-Carriern (PEO-NLC) eingebettet wurde, auf seine antibakterielle Aktivität untersucht. Die In-vitro-Analyse zeigte, dass sowohl die Applikation von Pfefferminzöl als auch seine nanoverkapselte Form (PEO-NLC) ähnliche antibakterielle Aktivitäten gegen Staphylococcus epidermidis, Staphylococcus aureus, Listeria monocytogenes, Escherichia coli und Pseudomonas aeruginosa Spezies aufwiesen. [36]
Das ätherische Öl von Mentha x piperita zeigte im Plattendiffusionstest signifikante Aktivität gegen humanpathogene Mikroorganismen. Getestet wurden 10 µl Pfefferminzöl auf Agarplatten, die mit Mikroorganismen-Suspensionen beimpft wurden. Die Stämme von Staphylococcus aureus, Micrococcus flavus, Bacillus subtilis, Staphylococcus epidermidis und Salmonella enteritides konnten signifikant in ihrem Wachstum gehemmt werden. Ein signifikant antimykotischer Effekt wurde gegen Alternaria alternaria, Fusarium tabacinum, Penicillum spp., Fusarium oxyporum und Aspergillus fumigates detektiert. [37]
Die antibakterielle Aktivität des ätherischen Öles von Mentha x piperita wurde gegen verschiedene Bakterienstämme mittels Plattendiffusionstest überprüft. Die getesteten Mikroorganismen konnten in ihrem Wachstum gehemmt werden, mit einer Sensitivität in absteigender Reihenfolge: Escherichia coli > Staphylococcus aureus > Pseudomonas aeruginosa > Enterococcus faecalis > Klebsiella pneumoniae. Pfefferminzöl wurde auch auf seine antioxidativen Eigenschaften überprüft. 50 μl einer 1:5-Konzentration des ätherischen Öls in Methanol wurden zu 5 ml einer 0,004%igen Methanol Lösung des stabilen freien Radikals DPPH (2,2-Diphenyl-1-picrylhydrazyl) gegeben. Die DPPH-Aktivität wurde um 63,82 ± 0,05 % mit einer IC50 von 3,9 µg/ml gehemmt. Außerdem hemmte Pfefferminzöl die Lipidperoxidation signifikant (p < 0,05) und ebenso stark wie das synthetische Antioxidans Butylhydroxytoluol (BHT) und stärker als Butylhydroxyanisol (BHA) (p < 0,001). [38]
Topische Anwendung
Menthol kann die Hautbarriere durchdringen und wirkt sogar als Penetrationsverstärker für andere Stoffe. Um dies zu verifizieren, wurden Menthol Konzentrationen von 0 (Kontrollgruppe), 1, 2, 3,5 und 5 % [m/m]) auf Hautproben von männlichen Sprague-Dawley-Ratten aufgetragen. Bei Konzentrationen von 3,5 % oder weniger veränderte Menthol die ursprüngliche Struktur des Stratum corneum in unterschiedlichem Maße, dadurch veränderte sich die Fluidität der Hautschicht und die Permeation und Speicherung des Menthols wurde erleichtert. Dies geschah über zwei Mechanismen: Zum einen zeigte Menthol eine starke Fähigkeit zur Wasserstoffbindung und konkurrierte mit Lipid-Lipid-Wasserstoffbrücken, wodurch diese geschwächt wurden. Zum anderen hatte Menthol eine starke Affinität zu Cholesterin, wahrscheinlich aufgrund ihrer strukturellen Ähnlichkeit, was darauf hindeutet, dass die Einarbeitung von Menthol die Fluidität der Lipidmembran ähnlich wie Cholesterin erhöhen kann. Diese Eigenschaften beweisen nicht nur die gute topische Anwendbarkeit von Menthol, sie machen es auch zu einem potenten Penetrationsverstärker. [39]
In-vivo-Studien
Zentralanalgetische Wirkung
Menthol zeigt direkte zentrale Wirkung und kann die Blut-Hirn-Schranke überwinden, wenn es systemisch verabreicht wird. Dies wurde in einem In-vivo-Experiment an Ratten bewiesen an denen, durch Pentetrazol-Gabe (PTZ), epileptische Anfälle ausgelöst wurden. PTZ greift an zentralen GABAA-Rezeptoren an und löst in hohen Dosen tonische und klonische Krämpfe aus. Die Verabreichung von Menthol (200 mg/kg, i.p.) verlängerte signifikant die Latenzzeit für klonische (p < 0,01) und tonische Anfälle (p < 0,05). Darüber hinaus reduzierte es deutlich die Mortalität der Mäuse. In derselben Publikation wurde in vitro gezeigt, dass Menthol die neuronale Erregung mindern konnte, da es selbst an GABAA-Rezeptoren angriff und dadurch die GABA-Wirkungen verstärkte. Dies lässt darauf schließen, dass systemisch verabreichtes Menthol sowohl die Blut-Hirn-Schranke überwinden als auch durch Potenzierung der GABA-Wirkungen zentrale antikonvulsive Effekte auslösen kann. [40]
Menthol wirkt zentral analgetisch durch Aktivierung des κ-Opioid-Systems.
(-)-Menthol erzeugte dosisabhängig eine Erhöhung der Schmerzschwelle im Hot-Plate-Test (3-10 mg/kg p.o.) und Abdominal Constriction-Test in Mäusen (3-10 mg/kg p.o.; 10 µg pro Maus intrazerebroventrikulär (i.c.v.)). Die antinozizeptive Wirkung von Menthol wurde durch den unselektiven Opioid-Antagonisten Naloxon und den selektiven κ-Opioid-Rezeptor-Antagonisten Norbinaltorphimin (nor-BNI) antagonisiert. (+)-Menthol zeigte dagegen in beiden Tests keine analgetischen Effekte. Diese Ergebnisse deuten darauf hin, dass (-)-Menthol schmerzlindernde Eigenschaften besitzt, die durch eine selektive Aktivierung von κ-Opioid Rezeptoren vermittelt wird. [41]
Auswirkungen auf die viszerale Empfindung im Magen-Darm-Trakt
Obwohl Pfefferminzöl landläufig hauptsächlich als topisches Analgetikum bekannt ist, beweisen Studien an Nagetieren, dass es auch viszerale Schmerzen verringern kann, wenn es oral oder intraperitoneal verabreicht wird. [42] Diese Schmerzminderung ist auf die Hemmung von TRPM8- und/oder TRPA1-Rezeptoren der Superfamilie der Transient-Receptor-Potential-Kationenkanäle, die sich im Darm befinden, zurückzuführen. [29,30]
Entzündungshemmende und antioxidative Effekte
Pfefferminzöl zeigte, basierend auf Tiermodellstudien an infizierten Wunden, beschleunigende Wundheilungsfähigkeit durch Reduktion der Entzündung, der Gewebebakterienzahl und des Ödemscores. Außerdem sah man eine entsprechende Steigerung der Neovaskularisation, Fibroblasten Infiltration, Kollagensynthese, Reepithelialisierung und Wundkontraktionsrate. Die Verwendung von Nanolipid-Carriern als Vehikel für Pfefferminzöl scheint eine geeignete Strategie zur Herstellung topischer Formulierungen für die Wundheilung zu sein. [36]
Die orale Verabreichung von Pfefferminzöl verhinderte die Essigsäure-induzierte Kolitis bei Ratten, wodurch auf einen entzündungshemmenden Effekt des Menthols geschlossen werden kann. [43]
Die Pfefferminze ist, durch die enthaltenen Polyphenole, eine bekannte Quelle für natürliche Antioxidantien. Um die Auswirkung des Lösungsmittels und der Extraktions-Bedingungen auf den Gesamt-Polyphenol-Gehalt (TPC) zu beurteilen, wurden verschiedene hydroethanolische Extrakte (96, 70 und 40% Ethanol) und Extraktionsverfahren (Mazeration im Dunkeln und unter Einstrahlung von Tageslicht, sowie Rückfluss) verwendet. Der Gesamtpolyphenolgehalt wurde als Gallussäureäquivalente (GAE) pro Milliliter des Extrakts oder GAE pro 100 g trockenes Pflanzenmaterial ausgedrückt. Als Extraktionsmittel erwies sich 70%iges Ethanol als das effektivste, da es den höchsten Gesamtpolyphenolgehalt mit beinahe 4000 GAE/100 g erzielte. Die Radikalfänger-Aktivität ausgedrückt in in GAE/ml, ist jene Hemmkonzentration (IC50), bei der 50% der freien Radikale 2,2-Diphenyl-1-picrylhydrazyl (DPPH) oder Galvinoxyl (GO) gehemmt wurden. Auch hier wurden vier verschieden ethanolische Lösungsmittel verwendet. Es wurde keine Korrelation zwischen TPC und Radikalfänger-Aktivität gefunden, dies kann mit der unterschiedlichen Polyphenol Zusammensetzung der verschiedenen Extrakte aus unterschiedlichen Lösungsmitteln begründet werden. Pfefferminzextrakte erwiesen sich mit 161 GAE/ml (96% Ethanol) im Vergleich zu Matricaria chamomilla und Lavandula angustifolia als die stärksten Radikalfänger. [44]
Anxiolytische Effekte
Studien an Nagetieren deuten darauf hin, dass Menthol durch seine Beteiligung an Dopamin-Signalwegen dosisabhängige anxiolytische Effekte hat. [45]
Angesichts der möglichen Rolle von psychosozialem Stress bei der Ausprägung von Symptomen funktioneller gastrointestinaler Schmerzstörungen, könnte dies ein weiterer möglicher Wirkmechanismus bei RDS sein.
Reizdarmsyndrom
In einer prospektiven randomisierten Studie aus Norwegen (PURSUADE) erhielten 189 ReizdarmpatientInnen (77,8 % Frauen) entweder dreimal täglich 182 mg Pfefferminzöl oder ein Placebo. Die Pfefferminzölgruppe nahm wiederum entweder Kapseln, die sich im Dünndarm (PO-SI) oder im Dickdarm (PO-IC) öffneten. Es wurden primäre Endpunkte in Übereinstimmung mit den EMA Richtlinien ausgewählt. Nach 8 Wochen sollte eine über 30 % Verminderung der stärksten abdominellen Schmerzen in mindestens der Hälfte der Zeit erreicht werden. Bei 46.8 % der PO-SI-Gruppe, 41.3 % der PO-IC-Gruppe und 34.4 % der Placebo-Gruppe war das auch der Fall, was wiederum zu keinem statistisch signifikanten Ergebnis führte. Nichtsdestotrotz konnten bei den sekundären Endpunkten einige wichtige Beobachtungen gemacht werden, die eine signifikante Überlegenheit der Pfefferminzöl-Kapseln mit Dünndarmfreisetzung gegenüber dem Placebo zeigten. Die am höchsten bewerteten abdominellen Schmerzen nahmen ab, generelle Bauchschmerzen verbesserten sich nach 6 Wochen, der IBS-Symptom-Score erfasste eine signifikante Verbesserung und beinahe doppelt so viele Personen der aktiven Gruppe zeigten zumindest eine moderate Verbesserung der allgemeinen Symptome (38,7 %) im Gegensatz zur Placebogruppe (20,3 %). Diese Ergebnisse zeigten, dass Pfefferminzöl als Zusatztherapie von Nutzen sein kann und sicher und gut verträglich in der Anwendung ist. [46]
72 PatientInnen (75 % Frauen), die die Rom-III-Kriterien für den Reizdarmsyndrom Misch- oder Durchfalltyp erfüllten, wurden in eine vierwöchige, randomisierte, doppelblinde, placebokontrollierte klinische Studie eingeschlossen. Sie erhielten entweder dreimal täglich Tabletten mit magensaftresistentem Pfefferminzöl (180 mg, n = 35) oder identische Placebokapseln (n = 37). Der primäre Endpunkt war die Veränderung des totalen IBS Symptom Scores (TISS). Das Endergebnis zeigte eine 40 % Reduktion des TISS gegenüber dem Ausgangswert (mittlere Änderung -1,16, SD ± 0,807) unter Pfefferminzöl und eine 24,3 % Abnahme (mittlere Änderung -0,70, SD ± 0,737) unter Placebo. (p = 0,0246). Die Abnahme des TISS nach 24 h war mit 19,6 % (mittlere Änderung -0,55, SD ± 0,613) in der PO-Gruppe signifikant höher als unter Placebo (-10,3 %, mittlere Änderung -0,27, SD ± 0,342) (p = 0,0092). Die neuartige Pfefferminzöl-Formulierung mit verzögerter Freisetzung im Dünndarm war sicher und effektiv in der Behandlung der IBS-Symptome. Es kam zu einer größeren Verbesserung mehrerer einzelner gastrointestinaler Symptome (auch schweren oder unerträglichen Symptomen) im Vergleich zu Placebo. [47]
In einer Humanstudie wurde der Akuteffekt von Pfefferminzöl (PO) auf das intragastrische Druckprofil (IGP) und die sensomotorischen Funktionen des Magens untersucht. Gesunde ProbandInnen unterzogen sich einer IGP-Messung vor und während Infusion eines Nährstoffgetränks (n = 13) und Stimulation der Druckrezeptoren der Magenwand durch Aufpumpen eines Ballons (n = 13). Es wurde entweder eine einzelne Kapsel Pfefferminzöl (182 mg) oder ein Placebo in einem randomisierten kontrollierten Crossover-Design verabreicht. Während des Fastens nahmen IGP und Motilitätsindex (MI) des proximalen Magens nach Pfefferminzöl-Verabreichung im Vergleich zu Placebo signifikant ab (p < 0,0001 bzw. <0,05). Die Empfindlichkeit gegenüber einer Ballondilatation unterschied sich nicht zwischen beiden Behandlungsarmen. Allerdings wurde nach der PO-Behandlung reduzierter Appetit während des Fastens im Vergleich zu Placebo beobachtet (p = 0,01). Pfefferminzöl reduzierte also IGP, Magenmotorik und Appetit, hatte aber wenig Auswirkungen auf Magensensibilität bei Gesunden. [48]
Die Studiengruppe um Alam und KollegInnen beobachteten in einer randomisierten placebokontrollierten Studie den Effekt von Pfefferminzölkapseln auf Verbesserung der Symptome des Reizdarmsyndroms und der Lebensqualität in PatientInnen, die überwiegend Durchfall hatten. 65 PatientInnen, die die Rom-II-Kriterien für RDS erfüllten, erhielten nach dem Zufallsprinzip 30 Minuten vor den Mahlzeiten, dreimal täglich, eine Kapsel mit entweder 0,2 ml Pfefferminzöl oder dem Placebo. Die Wirksamkeit wurde anhand eines Scoring-Systems (IBS-Score) überprüft. Der Unterschied zwischen den Gruppen nach sechs Wochen war signifikant (p > 0,001). Bei ReizdarmpatientInnen mit dem dominierenden Symptom Durchfall kam es zu einer Reduktion abdomineller Schmerzen. [49]
In einer randomisierten, doppelblinden, placebokontrollierten Studie an 90 ambulanten PatientInnen mit Reizdarmsyndrom, nahmen die ProbandInnen 8 Wochen lang dreimal täglich eine Kapsel mit 187 mg magensaftresistentem, verzögert freigesetztem Pfefferminzöl (n = 33) oder Placebo (n= 27) ein. Nach einer, vier und acht Wochen wurden die Symptome und Lebensqualität bewertet. Die Anzahl der ProbandInnen, die frei von Bauchschmerzen oder Beschwerden waren, stieg von 0 zu Beginn der Studie auf 14 in Woche 8 in der Pfefferminzöl-Gruppe und von 0 auf 6 in der Kontrollgruppe (p < 0,001). Auch der Schweregrad der Bauchschmerzen war in der Pfefferminzöl-Gruppe im Vergleich zu den Kontrollen signifikant reduziert. Außerdem verbesserte Pfefferminzöl signifikant die Lebensqualität, während es zu keinem signifikanten Auftreten unerwünschter Wirkungen kam. Die AutorInnen schlussfolgerten, dass Pfefferminzöl ein wirksames und sicheres Therapeutikum für PatientInnen mit Reizdarmsyndrom, die unter Bauchschmerzen oder Unwohlsein leiden, sei. [50]
Anwendung in der Koloskopie
Ein weiteres Anwendungsgebiet für Pfefferminzöl könnte wegen seiner spasmolytischen Wirkungen die Koloskopie sein. Dieser Eingriff ist für PatientInnen oft schmerzhaft und für ÄrztInnen schwierig, da es während der Prozedur zu Kolonspasmen kommen kann und so die Visualisierung der Schleimhaut behindert wird. Dadurch kommt es zu erhöhtem Lufteintritt, was zu immer größerer Dehnung und Unbehagen der PatientInnen führt.
In einer prospektiven, doppelblinden, placebokontrollierten klinischen Studie wurde die Wirksamkeit von magensaftresistenten Pfefferminzölkapseln als oral verabreichte antispasmodische Prämedikation bei der Koloskopie untersucht. 65 erwachsene PatientInnen, die sich einer Koloskopie unterzogen, wurden randomisiert, um vier Stunden vor dem Eingriff entweder 187 mg (0,2 ml) Pfefferminzöl in einer magensaftresistenten Hartgelatinekapsel (n = 33) oder eine Placebo-Kapsel (n = 32) zu erhalten. Die Endpunkte umfassten die Blinddarm-Intubation, die Gesamtdauer des Eingriffs, den Spasmus-Score, den Schmerz-Score, die Zufriedenheit des Endoskopikers und die Bereitschaft der PatientInnen zur Wiederholung der Koloskopie. Sowohl die Gesamtdauer der Prozedur als auch die Dauer der Intubation waren in der Pfefferminzöl-Gruppe kürzer als in der Placebo-Gruppe. Außerdem waren die Scores für Kolonspasmen und Schmerzen in der Pfefferminzöl-Gruppe signifikant niedriger. Der Endoskopiker war mit dem Eingriff in der Pfefferminzöl-Gruppe zufriedener und diese PatientInnen waren auch eher bereit, die Koloskopie in Zukunft zu wiederholen. [51]
Eine prospektive, randomisierte, einfach verblindete, placebokontrollierte Studie untersuchte insgesamt 226 PatientInnen, die sich einer Koloskopie unterziehen sollten. Ihnen wurden entweder 20 ml einer wässrigen 1,6%igen L-Menthol-Lösung (n = 118) oder ein Placebo (n = 108) verabreicht, beide Substanzen wurden über ein Endoskop lokal auf die Kolonschleimhaut gesprüht. Primäre und sekundäre Endpunkte waren die Adenom-Erkennungsrate (ADR) und der Anteil der PatientInnen ohne Peristaltik. Die Studie ergab eine signifikant höhere ADR in der L-Menthol-Gruppe als in der Placebo-Gruppe (60,2 % vs. 42,6 %; p = 0,0083). Auch der Anteil der PatientInnen, die nach der Behandlung mit L-Menthol keine Peristaltik hatten, war signifikant höher als in der Placebogruppe (71,2 % vs. 30,9 %; p < 0,0001). In beiden Gruppen traten keine unerwünschten Wirkungen auf. Die Ergebnisse legen nahe, dass die Unterdrückung der Kolonperistaltik durch L-Menthol, das direkt auf die Kolonschleimhaut gesprüht wird, die ADR verbessert. [52]
In einer multizentrischen, doppelblinden Phase-II-Dosis-Wirkungs-Studie wurde versucht, Magenspasmen, die während einer oberen gastrointestinalen Endoskopie auftreten, durch Pfefferminzöl zu reduzieren. 131 PatientInnen wurden in vier Gruppen geteilt und erhielten entweder 20 ml 0,4 %, 0,8 % oder 1,6 % L-Menthol oder ein Placebo in Form eines Sprays, der auf die Magenwand appliziert wurde. Die Magenperistaltik wurde zu Beginn der Endoskopie, nach 75 Sekunden, nach 105 Sekunden und am Ende durch eine Videoanalyse von ExpertInnen beurteilt. Die die Peristaltik unterdrückende Wirkung von L-Menthol nahm dosisabhängig zu (5,6%, 32,0%, 47,4% und 52,9% in den 0%, 0,4%, 0,8% bzw. 1,6% in den Gruppen; p < 0,001, einseitiger Cochran-Armitage-Trendtest). Im Vergleich zur Placebo-Gruppe war der Anteil der ProbandInnen, die nach der Verabreichung keine Peristaltik hatten, in der 0,8%-Gruppe und 1,6%-Gruppe signifikant höher (p = 0,015 und p = 0,009). Unerwünschte Ereignisse traten in den L-Menthol-Dosisgruppen mit ähnlicher Häufigkeit wie in der Placebo-Gruppe auf. L-Menthol unterdrückte die Peristaltik in einer dosisabhängigen Weise, mit einem Plateau bei 0,8 %. [22]
In einer randomisierten, kontrollierten, doppelt verblindeten, klinischen Studie wurden PatientInnen, die sich einer Screening-Koloskopie unterzogen, entweder 8 ml Pfefferminzöl in wässriger Lösung (42 ml Wasser) oder ein Placebo durch den Kanal des Koloskops appliziert. Nach Injektion der beiden Lösungen wurden Kolonperistaltik, Spastik und die Sichtbarkeit des Darms dokumentiert. 48 PatientInnen wurden eingeschlossen, von denen 24 Pfefferminzöl und 24 Placebo erhielten. Bei 58,3 % der PatientInnen in der Pfefferminzöl-Gruppe wurde eine vollständige Abwesenheit von Darmspastiken beobachtet, im Vergleich zu 45,8 % PatientInnen in der Placebogruppe (p = 0,05). Mehr als 75 % des Darms wurde bei 83 % der PatientInnen in beiden Gruppen sichtbar (p = 0,56). Die mittlere Adenom Detektionsrate (ADR) war in der Pfefferminzgruppe höher als in der Placebogruppe (45,8% vs. 37,5%; p = 0,56). Topisches Pfefferminzöl reduzierte die Spastizität der Darmwand, was zu einer besseren Visualisierung des Darmes während der Screening-Koloskopie führen könnte. [53]
Schmerz
38 PatientInnen, die bedingt durch Krebserkrankungen unter neuropathischen Schmerzen litten, nahmen an einer Proof-of-Concept-Studie teil. Die PatientInnen dieser Studie hatten entweder Chemotherapie-induzierte periphere Neuropathie oder Post-Mastektomie-Schmerzsyndrome. Das Ziel war es festzustellen, ob TRPM8-Ionenkanäle in sensorischen Neuronen, als neuartiges analgetisches Target des TRPM8-Aktivators Menthol, klinischen Nutzen bei PatientInnen mit neuropathischen Schmerzen haben könnten. Der schmerzhafte Bereich wurde zweimal täglich topisch mit einer Mentholcreme (1 %) behandelt. Der primäre Endpunkt war die Veränderung der Gesamtwerte des Brief-Pain-Inventory nach 4 – 6 Wochen. Zu den sekundären Endpunkten gehörten Veränderungen der Funktion, der Stimmung und des Hautgefühls. 82 % wiesen nach 6 Wochen eine Verbesserung der Gesamtwerte des Brief-Pain-Inventory auf (p < 0,001). Es wurden auch Verbesserungen der Stimmung (p = 0,0004), der Katastrophisierung (p = 0,001), der Gehfähigkeit (p = 0,008) und der Sensorik (p < 0,01) beobachtet. In dieser Studie konnten 50 % der PatientInnen als Responder eingestuft werden, da sie eine klinisch bedeutsame Verringerung der Schmerzintensität von ≤ 30 % aufwiesen. Dies deutet darauf hin, dass topisch appliziertes Menthol Potenzial als analgetische Therapie für krebsbehandlungsbedingte neuropathische Schmerzen haben könnte. [54]
Spannungskopfschmerz und Migräne
Kopfschmerzen vom Spannungstyp sind gemäß der Kopfschmerzklassifikationen der International Headache Society, der am häufigsten auftretende Typ. Die lokale topische Behandlung mit Pfefferminzöl zeigte in kontrollierten Studien gegenüber Placebo Signifikanz in Wirksamkeit und Sicherheit. Die zu Grunde liegenden Wirkmechanismen sind vielfältig und erklärbar über Aktivierung der Kältesensoren wie TRP-Rezeptoren und Blockade von Nozizeptoren und C-Fasern. In 10 % ethanolischer Lösung ist das ätherische Öl äußerlich zur Behandlung von Spannungskopfschmerzen bei Erwachsenen und Kindern ab dem sechsten Lebensjahr zugelassen. Pfefferminzöl wurde als Standardmedikament zur Akuttherapie in verschiedene Leitlinien von Fachgesellschaften aufgenommen, die sich mit Primären Kopfschmerzen befassen. [55]
In einer randomisierten, dreifach verblindeten, placebokontrollierte, Crossover-Studie wurden PatientInnen, die unter Migräneattacken litten, in zwei Gruppen eingeteilt. Sie wurden mit Menthol als 10 % ethanolische Lösung oder einem Placebo gleicher Form mit nur 0,5 % Menthol Gehalt behandelt. Die Lösungen wurden auf die Stirn und im Schläfenbereich aufgetragen und Schmerzfreiheit, Schmerzlinderung und anhaltende Schmerzfreiheit mittels Analogskala gemessen. Die Intention-to-Treat-Population bestand aus 35 PatientInnen (80 % Frauen, Durchschnittsalter: 29,6 ± 6,2) mit 118 Migräneattacken. Die Menthol-Lösung war dem Placebo sowohl bei der zweistündigen Schmerzfreiheit (p = 0,001), zweistündigen Schmerzlinderung (p = 0,000) als auch der anhaltenden Schmerzfreiheit und Schmerzlinderung (p = 0,008) überlegen. Die Menthol-Lösung war außerdem wirksamer bei der Linderung von Übelkeit und/oder Erbrechen sowie Phonophobie und ⁄oder Photophobie (p = 0,02). In der Per-Protocol-Population gab es eine signifikant höhere Anzahl von PatientInnen, die schmerzfrei waren oder zumindest Schmerzlinderung nach der Anwendung von Menthol gegenüber dem Placebo erfuhren (p = 0.002). Es zeigte sich kein signifikanter Unterschied zwischen den unerwünschten Wirkungen der Verum- und der Placebogruppe (p = 0,13). [56]
In einer doppelblinden, randomisierten, kontrollierten Studie wurden die Wirkungen von intranasalem Lidocain 4 % und ätherischen Pfefferminzöltropfen 1,5 % auf Migräneattacken gegenübergestellt. Es wurden 120 erwachsene PatientInnen (87 Frauen, 33 Männer), mit Migränediagnosen nach den Kriterien der International Headache Society, entweder nasal mit einem der beiden Wirkstoffe oder dem Placebo behandelt. Sie äußerten ihre Symptome 5 und 15 min nach dem Eintropfen und erhielten, wenn sie nach 15 min immer noch Kopfschmerzen hatten, eine zweite Dosis. Alle PatientInnen zeichneten ihre Symptome nach 30 min auf und füllten Fragebögen aus. Nach der Behandlung sah man einen signifikanten Unterschied in der Kopfschmerzintensität (p < 0,001). 42,1 % der Pfefferminzölgruppe und 41,5 % der Lidocain-Gruppe gaben an, dass die Intensität der Kopfschmerzen abnahm. In der Placebogruppe sprachen weniger PatientInnen in so hohem Maße auf die Behandlung an (4,9 %). Die nasale Anwendung von Pfefferminzöl führte zu einer deutlichen Reduktion der Intensität und Häufigkeit des Kopfschmerzes und linderte bei der Mehrheit der PatientInnen die Schmerzen ähnlich wie Lidocain. [57]
Dysmenorrhoe
Unter Dysmenorrhoe versteht man schmerzhafte Uteruskontraktionen während der Menstruation, die verbunden mit Übelkeit, Erbrechen und Durchfall sein können. Pfefferminzöl könnte durch seine analgetischen und krampflindernden Effekte hilfreich zur Linderung der Symptome bei Dysmenorrhoe sein.
In einer prospektive, doppelt verblindeten Crossover-Studie mit 127 Studentinnen, die an primärer Dysmenorrhoe litten, wurden die Effekte von Pfefferminzöl gegen Mefenaminsäure betrachtet. Jede Teilnehmerin wurde gebeten, ab der ersten Menstruation für drei Tage eines der Medikamente einzunehmen. Gruppe 1 erhielt für den ersten Zyklus drei Tage lang je drei Kapseln Pfefferminzöl täglich (187 mg), danach wurde ein Zyklus als Washout-Periode genutzt, um dann im dritten Zyklus drei Tage lang alle acht Stunden 250 mg Mefenaminsäure einzunehmen. Bei Gruppe 2 wurde genau umgekehrt verfahren. Am Ende jedes Zyklus füllten die Probandinnen einen Fragebogen aus und gaben die Schmerzintensität über die visuelle Analogskala (VAS), die Dauer des Schmerzes nach dem COX-Fragebogen und die Blutungsmenge nach der bildlichen Tabelle zur Bewertung des Blutverlustes (PBAC) an. Während sich die Blutungsmenge nicht signifikant veränderte, verringerten sich die Schmerzen und deren Schwere sowie alle klinischen Zeichen und Symptome nach der Einnahme von Pfefferminzextrakt. Die durchschnittliche Schmerzintensität und die Schmerzdauer waren nach Einnahme beider Substanzen signifikant geringer (p < 0,05). Übelkeit und Durchfall waren in der Pfefferminzölgruppe geringer als in der Mefenaminsäuregruppe. Den Probandinnen war es erlaubt, bei Bedarf, auch andere Analgetika einzunehmen. Bemerkenswert war, dass in der Mefenaminsäuregruppe nur 4,7 % weniger zusätzliche Analgetika genutzt wurden als in der Pfefferminzölgruppe. Auf Grund des besseren Nebenwirkungsprofils kann die Verwendung von Pfefferminzöl zur Behandlung von Dysmenorrhoe-Symptomen empfohlen werden. [58]
Kinder
In einer placebokontrollierten Studie mit 88 Kindern zwischen 4 und 13 Jahren, die unter abdominalen schmerzbedingten funktionellen Magen-Darm-Störungen litten, kam es unter der Einnahme von magensaftresistenten Pfefferminzölkapseln (187 mg, 3×1) nach einem Monat zu einer Reduktion der abdominellen Schmerzen. Pfefferminzöl reduzierte signifikant die Dauer, Schwere und Frequenz abdomineller Schmerzen und schnitt besser als das Synbiotikum (Bacillus coagulans + Fructooligosaccharide) oder Placebo ab. (p = 0,0001, p = 0,0001 bzw. p = 0,001) [59]
Die pharmakokinetischen Eigenschaften von Menthol bei Kindern nach einer Einzeldosis von 187 mg Pfefferminzöl wurden untersucht. Es wurden ProbandInnen mit Reizdarmsyndrom und pädiatrischem Rom II (n = 6; 7-15 Jahre alt) eingeschlossen. Vor der Pfefferminzöl-Verabreichung und zu verschiedenen Zeitpunkten bis zu 12 Stunden danach wurden Blutproben gesammelt. Nach einer Dosis Pfefferminzöl wurde bei allen ProbandInnen, eine erhebliche Verzögerung (Bereich 1-4 h) des Mentholpeaks beobachtet, was wiederum zu einer verzögerten Zeit der maximalen Plasmakonzentration (Tmax = 5,3 ± 2,4 h) führte (Cmax = 698,2 ± 245,4 ng/ml). Das verzögerte Auftreten von Menthol im Plasma nach oraler Pfefferminzöl-Verabreichung bei Kindern ist wahrscheinlich ein formulierungsspezifisches Ereignis, das bei RDS die intestinale Verweildauer des Wirkstoffs verlängern könnte. Die Daten belegen einen möglichen Nutzen von Pfefferminzöl bei Kindern mit Reizdarmsyndrom. [20]


