Vorbemerkung: Kurkuma wird von zwei verschiedenen Stammpflanzen gewonnen – Curcuma longa (CL) und Curcuma zanthorrhiza (CZ). In der weiteren Arbeit werden Angaben zu den beiden Stammpflanzen/ Drogen getrennt voneinander beschrieben, falls eine eindeutige Abgrenzung möglich war.

Botanischer Name
Curcuma longa L. (CL)
Curcuma zanthorrhiza Roxb. (auch Curcuma xanthorrhiza Roxb.) (CZ)
Familie
Zingiberaceae (Ingwergewächse)
Synonyme
Curcuma domestica Valenton (CL)
Curcuma zanthorrhiza D.Dietr. (CZ)
Sonstige Bezeichnungen
Kurkuma, Gelbwurzel (CL), Indian-saffron, tumeric, tumeric plant, long rooted curcuma (CL), Javanische Gelbwurz, Javanische Kurkuma (CZ), javanese turmeric (CZ)
Pflanzenteil
Curcumae longae rhizoma (Rhizom) (CL)
Curcumae zanthorrhizae rhizoma (Rhizom) (CZ)
(Wichtl, Blaschek, 2015)
Definition der Droge
Das ganze, von Wurzeln und äußerem Rindenbereich befreite, durch siedendes Wasser oder heißen Wasserdampf gebrühte, getrocknete Rhizom (CL)
Das in Scheiben geschnittene, getrocknete Rhizom (CZ)
(Europäisches Arzneibuch, 2017)
Nachweise:
Die Monografie entstand mit freundlicher Genehmigung nach einer Bachelorarbeit von Christine Bucar (2020).
Baum, L.; Lam, C. W. K.; Cheung, S. K.-K.; Kwok, T.; Lui, V.; Tsoh, J.; Lam, L.; Leung, V.; Hui, E.; Ng, C.; Woo, J.; Chiu, H. F. K.; Goggins, W. B.; Zee, B. C.-Y.; Cheng, K. F.; Fong, C. Y. S.; Wong, A.; Mok, H.; Chow, M. S. S.; Ho, P. C.; Ip, S. P.; Ho, C. S.; Yu, X. W.; Lai, C. Y. L.; Chan, M.-H.; Szeto, S.; Chan, I. H. S.; Mok, V. Six-month randomized, placebo-controlled, double-blind, pilot clinical trial of curcumin in patients with Alzheimer disease. Journal of Clinical Psychopharmacology 2008, 28 (1), 110–113. DOI: 10.1097/jcp.0b013e318160862c.
Chrubasik-Hausmann, S. Kurkuma. https://www.uniklinik-freiburg.de/fileadmin/mediapool/08_institute/rechtsmedizin/pdf/Addenda/2016/Kurkuma_-_Wissenschaftliche_Zusammenfassung_2015.pdf (accessed January 8, 2020).
Cox, K. H. M.; Pipingas, A.; Scholey, A. B. Investigation of the effects of solid lipid curcumin on cognition and mood in a healthy older population. Journal of Psychopharmacology (Oxford, England) 2015, 29 (5), 642–651. DOI: 10.1177/0269881114552744.
DiSilvestro, R. A.; Joseph, E.; Zhao, S.; Bomser, J. Diverse effects of a low dose supplement of lipidated curcumin in healthy middle aged people. Nutrition Journal 2012, 11, 79. DOI: 10.1186/1475-2891-11-79.
Europäisches Arzneibuch. Amtliche deutsche Ausgabe; Deutscher Apotheker Verlag: Stuttgart, 2017; S. 2016-2018, 2062-2064.
European Medicines Agency. Community herbal monograph on Curcuma xanthorrhiza Roxb. (C. xanthorrhiza D. Dietrich), rhizoma 2014.
European Medicines Agency. European Union herbal monograph on Curcuma longa L., 2018.
European Scientific Cooperative on Phytotherapy. ESCOP monographs, 2. ed., completely rev. and expanded.; ESCOP: Exeter, 2003; 107-117.
European Scientific Cooperative on Phytotherapy. ESCOP monographs, 2. ed.; ESCOP: Exeter, 2009; 57-68.
Fan, C.; Song, Q.; Wang, P.; Li, Y.; Yang, M.; Yu, S. Y. Neuroprotective Effects of Curcumin on IL-1β-Induced Neuronal Apoptosis and Depression-Like Behaviors Caused by Chronic Stress in Rats. Frontiers in Cellular Neuroscience 2018, 12, 516. DOI: 10.3389/fncel.2018.00516.
Garcia-Alloza, M.; Borrelli, L. A.; Rozkalne, A.; Hyman, B. T.; Bacskai, B. J. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry 2007, 102 (4), 1095–1104. DOI: 10.1111/j.1471-4159.2007.04613.x.
Geisslinger, G.; Menzel, S.; Gudermann, T.; Hinz, B.; Ruth, P. Mutschler Arzneimittelwirkungen. Pharmakologie – Klinische Pharmakologie – Toxikologie, 11. völlig neu bearbeitete Auflage; Wissenschaftliche Verlagsgesellschaft: Stuttgart, 2019; S. 342-346.
Gota, V. S.; Maru, G. B.; Soni, T. G.; Gandhi, T. R.; Kochar, N.; Agarwal, M. G. Safety and pharmacokinetics of a solid lipid curcumin particle formulation in osteosarcoma patients and healthy volunteers. Journal of Agricultural and Food Chemistry 2010, 58 (4), 2095–2099. DOI: 10.1021/jf9024807.
LaFerla, F. M.; Green, K. N.; Oddo, S. Intracellular amyloid-beta in Alzheimer’s disease. Nature Reviews. Neuroscience 2007, 8 (7), 499–509. DOI: 10.1038/nrn2168.
Länger, R.; Kubelka, W. Phytokodex. Pflanzliche Arzneispezialitäten in Österreich ; 2001/2002; Krause & Pachernegg: Wien, 2001.
Long, J. M.; Holtzman, D. M. Alzheimer Disease: An Update on Pathobiology and Treatment Strategies. Cell 2019, 179 (2), 312–339. DOI: 10.1016/j.cell.2019.09.001.
Mohandas, E.; Rajmohan, V.; Raghunath, B. Neurobiology of Alzheimer’s disease. Indian Journal of Psychiatry 2009, 51 (1), 55–61. DOI: 10.4103/0019-5545.44908.
Müller, U. C.; Deller, T.; Korte, M. Not just amyloid: physiological functions of the amyloid precursor protein family. Nature Reviews. Neuroscience 2017, 18 (5), 281–298. DOI: 10.1038/nrn.2017.29.
Nelson, K. M.; Dahlin, J. L.; Bisson, J.; Graham, J.; Pauli, G. F.; Walters, M. A. The Essential Medicinal Chemistry of Curcumin. Journal of Medicinal Chemistry 2017, 60 (5), 1620–1637. DOI: 10.1021/acs.jmedchem.6b00975.
Ringman, J. M.; Frautschy, S. A.; Teng, E.; Begum, A. N.; Bardens, J.; Beigi, M.; Gylys, K. H.; Badmaev, V.; Heath, D. D.; Apostolova, L. G.; Porter, V.; Vanek, Z.; Marshall, G. A.; Hellemann, G.; Sugar, C.; Masterman, D. L.; Montine, T. J.; Cummings, J. L.; Cole, G. M. Oral curcumin for Alzheimer’s disease: tolerability and efficacy in a 24-week randomized, double blind, placebo-controlled study. Alzheimer’s Research & Therapy 2012, 4 (5), 43. DOI: 10.1186/alzrt146.
Leitfaden Phytotherapie; Schilcher, H., Fischer, M., Frank, B., Kammerer, S., Wegener, T., Eds., 5. Auflage; Elsevier Urban & Fischer: München, 2016; S. 103-107.
Scholey, A.; Cox, K.; Pipingas, A.; White, D. A Highly Bioavailable Curcumin Extract Improves Neurocognitive Function and Mood in Healthy Older People: A 12-Week Randomised, Double-Blind, Placebo-Controlled Trial (OR32-05-19). Current Developments in Nutrition 2019, 3 (Supplement_1). DOI: 10.1093/cdn/nzz052.OR32-05-19.
Silbernagl, S.; Lang, F. Taschenatlas Pathophysiologie, 3., vollst. überarb. und erw. Aufl.; Thieme: Stuttgart, 2009; 370-371.
Small, G. W.; Siddarth, P.; Li, Z.; Miller, K. J.; Ercoli, L.; Emerson, N. D.; Martinez, J.; Wong, K.-P.; Liu, J.; Merrill, D. A.; Chen, S. T.; Henning, S. M.; Satyamurthy, N.; Huang, S.-C.; Heber, D.; Barrio, J. R. Memory and Brain Amyloid and Tau Effects of a Bioavailable Form of Curcumin in Non-Demented Adults: A Double-Blind, Placebo-Controlled 18-Month Trial. The American Journal of Geriatric Psychiatry 2018, 26 (3), 266–277. DOI: 10.1016/j.jagp.2017.10.010.
Staesche, K.; Schleinitz, H. Curcuma, 5., vollständig neubearbeitete Auflage; Hagers Handbuch der pharmazeutischen Praxis; Springer: Berlin, London, 1999; S. 1084-1099.
Sticher, O.; Heilmann, J.; Zündorf, I. Pharmakognosie – Phytopharmazie, 10., völlig neu bearbeitete Auflage; Wissenschaftliche Verlagsgesellschaft: Stuttgart, 2015; S. 692-695.
Sundaram, J. R.; Poore, C. P.; Sulaimee, N. H. B.; Pareek, T.; Cheong, W. F.; Wenk, M. R.; Pant, H. C.; Frautschy, S. A.; Low, C.-M.; Kesavapany, S. Curcumin Ameliorates Neuroinflammation, Neurodegeneration, and Memory Deficits in p25 Transgenic Mouse Model that Bears Hallmarks of Alzheimer’s Disease. Journal of Alzheimer’s Disease : JAD 2017, 60 (4), 1429–1442. DOI: 10.3233/JAD-170093.
Tai, Y.-H.; Lin, Y.-Y.; Wang, K.-C.; Chang, C.-L.; Chen, R.-Y.; Wu, C.-C.; Cheng, I. H. Curcuminoid submicron particle ameliorates cognitive deficits and decreases amyloid pathology in Alzheimer’s disease mouse model. Oncotarget 2018, 9 (12), 10681–10697. DOI: 10.18632/oncotarget.24369.
Tan, S.; Calani, L.; Bresciani, L.; Dall’asta, M.; Faccini, A.; Augustin, M. A.; Gras, S. L.; Del Rio, D. The degradation of curcuminoids in a human faecal fermentation model. International Journal of Food Sciences and Nutrition 2015, 66 (7), 790–796. DOI: 10.3109/09637486.2015.1095865.
Teuscher, E.; Melzig, M. F.; Lindequist, U. Biogene Arzneimittel. Ein Lehrbuch der pharmazeutischen Biologie, 7., neu bearbeitete und erweiterte Auflage; Wissenschaftliche Verlagsgesellschaft: Stuttgart, 2012; S. 298.
Tsai, S.-J. Effects of interleukin-1beta polymorphisms on brain function and behavior in healthy and psychiatric disease conditions. Cytokine & Growth Factor Reviews 2017, 37, 89–97. DOI: 10.1016/j.cytogfr.2017.06.001.
Vaupel, P.; Schaible, H.-G.; Mutschler, E. Anatomie, Physiologie, Pathophysiologie des Menschen. 158 Tabellen, 7., vollst. überarb. und erw. Aufl.; Wissenschaftliche Verlagsgesellschaft Stuttgart: Stuttgart, 2015; S. 883.
Weltgesundheitsorganisation. WHO monographs on selected medicinal plants; World Health Organization: Geneva, 1999.
Wichtl, M.; Blaschek, W. Wichtl – Teedrogen und Phytopharmaka. Ein Handbuch für die Praxis, 6th ed.; Wissenschaftliche Verlagsgesellschaft Stuttgart: Stuttgart, 2015; S. 210-215.
Die Droge besteht aus den Rhizomen der Curcuma-Arten Curcuma longa L. und Curcuma zanthorrhiza Roxb (Zingiberaceae). Sowohl Curcuma longa als auch Curcuma zanthorrhiza sind aufrechte, ausdauernde Rhizomstauden, die in den tropischen Teilen Asiens beheimatet sind.
Eine Besonderheit der rund 1 m hohen Curcuma longa sind die bis zu 1,2 m langen Blätter. Sie besitzen eine eiförmig-lanzettliche, ganzrandige Blattspreite und wachsen grundständig aus dem Rhizom. Das Rhizom besteht aus einem knollig verdickten Hauptrhizom und fingerförmigen Nebenrhizomen. Aus dem Hauptrhizom entspringen die Wurzeln. Curcuma longa besitzt zapfenartige Blütenstände, in denen sich neben den gelblich-weißen bis orangen zygomorphen Blüten auch blassgrüne Hochblätter und weißliche, oft rötlich getönte Deckblätter befinden. Die Blüten sind aus einem dreilappigen, röhrenförmigen Kelch und einer trichterförmigen, dreizipfeligen Krone aufgebaut. Außerdem besitzen sie gelbliche Staminodien (unfruchtbare Staubblätter), ein fertiles Staubblatt, einen oberständigen Fruchtknoten und ein Labellum (Lippe, markantes medianes Kronblatt). Die Früchte der Curcuma longa sind kugelige Kapselfrüchte.
Curcuma zanthorrhiza ist mit einer Höhe von bis zu 1,75 m größer als Curcuma longa. Auch die Blätter der Curcuma zanthorrhiza sind mit 1,50 m ein wenig länger als die der Curcuma longa, mit einer breit-lanzettlichen oder länglich-eiförmigen Blattspreite und einem purpurnen Fleck an der Mittelrippe. Sie besitzt wie Curcuma longa ein knolliges, eiförmiges Rhizom aus dem direkt die Blätter entspringen, genauso wie Wurzeln und dünne Nebenrhizome. Eine weitere Gemeinsamkeit der beiden Curcuma-Arten sind die zapfenartigen Blütenstände in Bodennähe, die auch direkt aus dem Rhizom entspringen. Die großen trichterförmigen Blüten sind purpur- oder karminrot und besitzen ebenfalls nur ein fertiles Staubblatt.
Während Curcuma longa hauptsächlich im tropischen Indien beheimatet ist, befindet sich die Heimat der Curcuma zanthorrhiza vor allem in Waldgebieten Indonesiens.
(Staesche, Schleinitz, 1999, Wichtl, Blaschek, 2015)

Abb.1: Curcuma longa
Droge
Die Droge der Curcuma longa besteht aus den nach der Ernte mit siedendem Wasser oder heißem Wasserdampf abgebrühten und getrockneten Wurzelstöcken der Pflanze. Das Abbrühen ist notwendig, da das innere Gewebe des Rhizoms von einer dicken Korkschicht umgeben ist und dadurch das Wasser nur schwer abgibt. Dieses Verfahren hat zur Folge, dass die im Rhizom enthaltene Stärke verkleistert, wodurch die Droge nach dem Trocknen „hornartig“ wirkt. (Sticher et al., 2015)
Die als Droge verwendeten knolligen, bis zu 4 cm langen Hauptrhizome mit quergeringelten Blattnarben und die fingerförmigen, bis zu 15 mm dicken Nebenrhizome mit Narben der Seitenzweige der Curcuma longa haben nach dem Abbrühen außen eine gelbe, graubraune bzw. fleckige Färbung. Der Geruch der Droge ist schwach aromatisch-würzig und der Geschmack brennend scharf und bitter. (Wichtl, Blaschek, 2015)
Im Gegensatz zur Curcuma longa wird das frische Rhizom der Curcuma zanthorrhiza nicht abgebrüht, sondern nur geschnitten und getrocknet. (Sticher et al., 2015) Die Droge besteht somit aus wenigen
Millimeter dicken, orangegelben bis graubraunen Scheiben oder Bruchstücken des Rhizoms, die einen intensiv aromatischen Geruch und würzigen, bitteren und scharfen Geschmack besitzen. (Wichtl, Blaschek, 2015)
Laut Europäischem Arzneibuch (9. Ausgabe) soll die wasserfreie Droge der Curcuma longa einen Gehalt an ätherischem Öl von mindestens 25 ml/kg aufweisen. Der Gehalt an Dicinnamoylmethan-Derivaten, berechnet als Curcumin (C21H20O6; Mr 368,4) soll mindestens 2% betragen. Die wasserfreie Droge der Javanischen Gelbwurz soll mindestens 50 ml/kg an ätherischem Öl und 1% an Dicinnamoylmethanen, ebenfalls berechnet als Curcumin, enthalten. Bei der Curcuma-Droge wird der Wassergehalt bestimmt und nicht der Trocknungsverlust, da bei der Trocknung zur Gewichtskonstanz auch das ätherische Öl verloren gehen würde.
(Europäisches Arzneibuch, 2017)
Die Hauptinhaltsstoffe von Curcumae longae rhizoma und Curcumae zanthorrhizae rhizoma sind Curcuminoide (Dicinnamoylmethan-Derivate bzw. Diarylheptanoide), ätherisches Öl und Stärke. In der genauen Zusammensetzung unterscheiden sich die Rhizome der beiden Curcuma-Arten jedoch geringfügig.
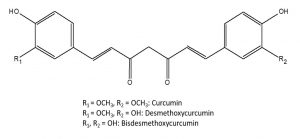
Abb. 2: Strukturformeln der 3 Curcuminoide
Die Rhizome der Curcuma longa enthalten 3-5% Curcuminoide, davon hauptsächlich Curcumin (ca. 90% der Curcuminoide), aber auch Monodesmethoxy- und Bisdesmethoxycurcumin. Weiters enthalten sie 2-7% ätherisches Öl, welches vorwiegend aus Sesquiterpenen besteht. Die geruchsbestimmenden Komponenten des ätherischen Öls sind alpha-, beta- und ar-Turmeron. Das Rhizom besteht zu 30-40 % aus Stärke, die durch das Abbrühen weitgehend verkleistert.
Der Anteil an Curcuminoiden der Curcumae zanthorrhizae rhizoma ist mit 1-2% etwas geringer als bei den Rhizomen der Curcuma longa. Hauptbestandteile sind Curcumin und Monodesmethoxycurcumin (im Mengenverhältnis von ca. 1,7:1) und nur zu einem geringen Anteil Bisdesmethoxycurcumin. Ätherisches Öl enthält die Zanthorrhiza-Droge 3-12 %, das vor allem aus Sesquiterpenen wie ar-Curcumen, Xanthorrhizol, ß-Curcumen und Germacron besteht. Außerdem enthält sie einige Reservestoffe, wie Stärke (30-40%), Zucker, andere Polysaccharide und fettes Öl. Die Stärke ist unverkleistert, da die Droge nicht abgebrüht wird.
Obwohl das Curcuma longa-Rhizom und das Curcuma zanthorrhiza-Rhizom eine ähnliche chemische Zusammensetzung aufweisen, kann man sie anhand qualitativer und quantitativer Analysen unterscheiden, im Detail mithilfe des Curcuminoidspektrums und aufgrund von Xanthorrhizol, welches nur in C. zanthorrhiza vorkommt.
(Länger, Kubelka, 2001, Sticher et al., 2015, Wichtl, Blaschek, 2015)
Kurkumapulver ist seit Jahrtausenden in Verwendung als wesentlicher Bestandteil indischer Gewürzmischungen, die in der westlichen Welt als „Curry“ bekannt sind. Es findet jedoch auch in der traditionellen asiatischen und indischen Medizin seine Verwendung. Volksmedizinisch wird es vor allem eingesetzt bei Gallenbeschwerden, Verdauungsstörungen und als Karminativum. Im Gegensatz zu heute wurde die Droge der Curcuma longa früher hauptsächlich als Gewürz und Farbstoff eingesetzt, während die Droge der Curcuma zanthorrhiza als Heilmittel zur Behandlung von Leber- und Gallenleiden verwendet wurde. Heute werden die beiden Drogen als gleichwertig betrachtet. Nach Europa gelangte das Gewürz im Mittelalter und erst seit Kurzem wird Kurkuma in Europa auch vermehrt medizinisch genutzt.
(Chrubasik-Hausmann, 2015, Sticher et al., 2015, Wichtl, Blaschek, 2015)
.
Die Drogen der Curcuma-Arten wirken hauptsächlich antiphlogistisch (entzündungshemmend) und choleretisch (Gallenfluss fördernd) beziehungsweise cholagog (gallentreibend). Neuere Untersuchungen geben auch Hinweise auf eine antioxidative, hepatoprotektive, antihepatotoxische, antivirale und tumorhemmende Wirkung von Kurkuma. Eine Besonderheit der Longa-Droge ist eine geringe spasmolytische Wirkung, während die Xanthorrhiza-Droge geringfügig antibakteriell gegen gramnegative Bakterien wirkt. (Schilcher et al., 2016)
In den Monographien von EMA HMPC (European Medicines Agency Commitee on Herbal Medicinal Products), ESCOP (European Scientific Cooperative on Phytotherapy) und WHO (World Health Organization) gibt es Angaben zu den Indikationsgebieten von Kurkuma. Die EMA-Monographie gibt Erhöhung des Gallenflusses und Linderung der Symptome von Verdauungsproblemen (zum Beispiel Völlegefühl, langsame Verdauung, Flatulenz) als Einsatzgebiete an. Curcuma longae rhizoma und Curcuma zanthorrhizae rhizoma sind laut HMPC (Commitee on Herbal Medicinal Products) unter „traditional use“ gelistet. Dies bedeutet, dass die Unbedenklichkeit und Wirksamkeit durch Überlieferung und langjährige Erfahrung plausibel ist und nicht durch experimentelle klinische Daten nachgewiesen wurde. In der WHO Monographie werden als Indikationsgebiete Übersäuerung, Flatulenz, atonische Dyspepsie und peptische Geschwüre angegeben, außerdem Schmerzen und Entzündungen aufgrund rheumatischer Arthritis, Amenorrhö, Dysmenorrhö, Diarrhö, Epilepsie, Schmerzen und Hautkrankheiten (lokale Anwendung). Im Vergleich dazu sind die Indikationen nach der ESCOP- Monographie leichte Verdauungsbeschwerden und leichte Gallenfunktionsstörungen. (European Medicines Agency, 2014, 2018, European Scientific Cooperative on Phytotherapy, 2003, 2009, Weltgesundheitsorganisation, 1999)
Weitere potentielle Anwendungsgebiete von Kurkuma sind Alzheimer-Demenz, Tumorerkrankungen, Psoriasis und Mukoviszidose. (Teuscher et al., 2012)
Laut ESCOP Monographie beträgt die Tagesdosis der Curcumae longae rhizoma für Erwachsene und ältere Personen 1,5-3 g der Droge bzw. der entsprechenden Extrakte. Es gibt keine Einschränkungen bezüglich Langzeiteinnahme. Die Applikation erfolgt peroral. (European Scientific Cooperative on Phytotherapy, 2003, 2009)
Die EMA-Monographie über Curcumae longae rhizoma unterscheidet bei der Dosierung zwischen unterschiedlichen Darreichungsformen. Als pulverisierte und zerkleinerte pflanzliche Substanz wird eine Dosis von 0,5-1 g 2-3 mal täglich empfohlen. Als Teezubereitung soll man 0,5-1 g zerkleinerte Droge mit 150 ml kochendem Wasser aufgießen und 2 bis 3 mal täglich peroral anwenden. Es wird zwischen Trockenextrakten im Droge-Extrakt-Verhältnis 13-25: 1 mit 96%igem Ethanol als Extraktionsmittel und Trockenextrakten im Droge-Extrakt-Verhältnis 5,5-6,5:1 mit 50%igem Ethanol als Extraktionsmittel unterschieden. Die Dosierung des Trockenextraktes im Verhältnis 13-25:1 beträgt 90-162 mg, aufgeteilt auf 2-5 Dosen täglich und die des Trockenextraktes im Verhältnis 5,5-6,5:1 100-200 mg, 2 mal täglich. Von Curcumae longae rhizoma sind Tinkturen im Verhältnis 1:5 und 1:10 mit 70%igem Ethanol als Lösungsmittel in Verwendung. Von der Tinktur im Verhältnis 1:5 sollen 10 ml einmal täglich oder 5 ml in 60 ml Wasser 3 mal täglich eingenommen werden. Von der Tinktur im Verhältnis 1:10 sollen 0,5-1 ml 3 mal täglich verabreicht werden. (European Medicines Agency, 2018)
Im Gegensatz dazu beträgt die Tagesdosis der Curcumae zanthorrhizae rhizoma für Erwachsene und ältere Personen laut ESCOP Monographie 2 g der Droge bzw. analogen Extrakten. Auch hier gibt es keine Einschränkungen bezüglich Langzeitanwendung und die Darreichungsformen werden peroral angewendet. (European Scientific Cooperative on Phytotherapy, 2009)
In der EMA-Monographie von Curcumae zanthorrhizae rhizoma werden Dosierungen für Trockenextrakte mit 96%igem Ethanol als Lösungsmittel (DEV 20-50:1) oder mit Aceton als Lösungsmittel (DEV 9-12:1), sowie für pflanzliche Teezubereitungen unterschieden. Für pflanzliche Teezubereitungen sollen als Einzeldosis 1 g der zerkleinerten pflanzlichen Substanz mit 100 ml kochendem Wasser aufgegossen werden und 3 mal täglich eingenommen werden. Die Einzeldosis für Trockenextrakte mit Ethanol als Lösungsmittel (DEV 20-50:1) beträgt 8-13 mg und soll 3 mal täglich angewendet werden. Die Einzeldosis für Trockenextrakte mit Aceton als Lösungsmittel (DEV 9-12:1) beträgt 50-100 mg und soll 2 mal täglich eingenommen werden. Alle Darreichungsformen der Curcuma-Arten sind pflanzliche Zubereitungen zur peroralen Anwendung.
(European Medicines Agency, 2014)
Dieses Kapitel bezieht sich sowohl auf die Sicherheit von Curcumae longae rhizoma als auch von Curcumae zanthorrhizae rhizoma, da die Angaben für diese ident sind. (European Medicines Agency, 2014, 2018)
Unerwünschte Wirkungen/ Toxizität
Als Nebenwirkungen von Präparaten, die Kurkuma enthalten, werden in der EMA-Monographie leichte Formen von Mundtrockenheit, Flatulenz und Gallenirritationen angegeben. Die Häufigkeit dieser Beschwerden ist jedoch nicht bekannt.
Selten können auch unerwünschte Wirkungen wie Magen-Darm-Beschwerden, Sodbrennen, Übelkeit, Brechreiz oder Diarrhö auftreten. (Wichtl, Blaschek, 2015)
Falls andere unerwünschte Wirkungen auftreten, wird empfohlen eine medizinische Fachperson zu kontaktieren.
(European Medicines Agency, 2014, 2018)
Kontraindikationen/ Anwendungsbeschränkungen
Durch die mögliche Gallensekretion-stimulierende Wirkung der Curcuma-Arten sollte man bei einer Verstopfung des Gallengangs, Cholangitis, Lebererkrankungen, Gallensteinen und anderen biliären Erkrankungen auf die Verwendung von Präparaten, die Kurkuma enthalten, verzichten. Eine weitere Kontraindikation ist eine Überempfindlichkeit gegenüber der aktiven Substanz.
Aufgrund fehlender Daten hat sich die Verwendung von Kurkuma-hältigen Präparaten für Kinder und Jugendliche unter 18 Jahren nicht etabliert. Auch für die Verwendung in der Schwangerschaft und Stillperiode liegen nicht genügend Daten vor und sie wird daher nicht empfohlen. Es ist kein Fall von Überdosierung bekannt.
(European Medicines Agency, 2014, 2018)
Wechselwirkungen
Wechselwirkungen mit anderen medizinischen Produkten und andere Formen der Interaktion wurden nicht dokumentiert. (European Medicines Agency, 2014, 2018) In verschiedenen Studien wurde Kurkuma unter anderem mit Piperin, Sojalecithin, Quercetin, Isoflavon, Gemcitabin und Docetaxel kombiniert, wobei keine Wechselwirkungen beobachtet wurden. (Chrubasik-Hausmann, 2015)
Vorbemerkung zur Bioverfügbarkeit
Die große Problematik bei Curcumin und anderen Curcuminoiden ist deren Unlöslichkeit in Wasser bei Raumtemperatur und neutralem pH-Wert und die damit verbundene schlechte, vor allem orale Bioverfügbarkeit der Kurkuma-Diarylheptanoide. Daher wurde Curcumin auch von einer Übersichtsarbeit zur derzeitigen Studienlage über Curcumin aus dem Jahr 2017 als IMPS (invalid metabolic panacea), also als unwirksames metabolisches Allheilmittel bezeichnet (Nelson et al., 2017). Denn obwohl es vielversprechende in vitro Studien zur Wirksamkeit von Curcumin in verschiedensten Bereichen gab, war Curcumin unter den Assaybedingungen oft nicht stabil und die beobachteten Effekte könnten daher von meist nicht näher definierten Abbauprodukten stammen. Außerdem wurde Curcumin als PAINS (pan-assay interference compound) bezeichnet, also als Verbindung, die chemische Aktivität durch Interaktion mit der Untersuchungsmethode und nicht durch spezifische Substanz-Target-Wechselwirkung aufweist (Nelson et al., 2017). Aufgrund des Absorptions- und Emissionsbereichs der Substanz sind vor allem diejenigen in-vitro-Assays problematisch, die ein Fluoreszenz-basiertes Readout verwenden. Diese Eigenschaften könnten auch der Grund sein, weshalb bisher auch bei keiner randomisierten Placebo-kontrollierten klinischen Studie ein signifikanter positiver Einfluss von Curcumin auf einen Krankheitsverlauf nachgewiesen werden konnte. Der Review von Nelson et al. befasste sich jedoch ausschließlich mit nicht modifizierten Curcumin-Extrakten und weist auch darauf hin, dass mithilfe von Nanopartikel-Technologie und Lipid-Ummantelung die chemische Stabilität und damit Bioverfügbarkeit der Substanz erhöht werden kann, was einen erheblichen Einfluss auf die Wirksamkeit von Curcumin haben kann. (Nelson et al., 2017)
Ein weiteres Problem vieler wissenschaftlicher Studien zur Wirksamkeit von Curcumin ist die oft uneindeutige Deklaration der Bezeichnung „Curcumin“. Es ist in vielen Fällen nicht definiert, ob es sich bei der Bezeichnung „Curcumin“ um ein Synonym für diverse Curcuminoide handelt, bzw. die Anteile der verschiedenen Curcuminoide sind nicht angeführt. (Nelson et al., 2017)
Eine in-vivo-Studie aus dem Jahr 2007 stellte mithilfe von Multiphoton Mikroskopie bei transgenen APP Mäusen nach i.v. Injektion von Curcumin über 7 Tage fest, dass Curcumin die Blut-Hirn-Schranke überwinden konnte und sich an bestehende Amyloid-Ablagerungen anheftete. (Garcia-Alloza et al., 2007)
Abbauprodukte der Curcuminoide
bei Raumtemperatur und neutralem pH-Wert und die damit verbundene schlechte, vor allem orale Bioverfügbarkeit der Kurkuma-Diarylheptanoide. Daher wurde Curcumin auch von einer Übersichtsarbeit zur derzeitigen Studienlage über Curcumin aus dem Jahr 2017 als IMPS (invalid metabolic panacea), also als unwirksames metabolisches Allheilmittel bezeichnet (Nelson et al., 2017). Denn obwohl es vielversprechende in vitro Studien zur Wirksamkeit von Curcumin in verschiedensten Bereichen gab, war Curcumin unter den Assaybedingungen oft nicht stabil und die beobachteten Effekte könnten daher von meist nicht näher definierten Abbauprodukten stammen. Außerdem wurde Curcumin als PAINS (pan-assay interference compound) bezeichnet, also als Verbindung, die chemische Aktivität durch Interaktion mit der Untersuchungsmethode und nicht durch spezifische Substanz-Target-Wechselwirkung aufweist (Nelson et al., 2017). Aufgrund des Absorptions- und Emissionsbereichs der Substanz sind vor allem diejenigen in-vitro-Assays problematisch, die ein Fluoreszenz-basiertes Readout verwenden. Diese Eigenschaften könnten auch der Grund sein, weshalb bisher auch bei keiner randomisierten Placebo-kontrollierten klinischen Studie ein signifikanter positiver Einfluss von Curcumin auf einen Krankheitsverlauf nachgewiesen werden konnte. Der Review von Nelson et al. befasste sich jedoch ausschließlich mit nicht modifizierten Curcumin-Extrakten und weist auch darauf hin, dass mithilfe von Nanopartikel-Technologie und Lipid-Ummantelung die chemische Stabilität und damit Bioverfügbarkeit der Substanz erhöht werden kann, was einen erheblichen Einfluss auf die Wirksamkeit von Curcumin haben kann. (Nelson et al., 2017)
Ein weiteres Problem vieler wissenschaftlicher Studien zur Wirksamkeit von Curcumin ist die oft uneindeutige Deklaration der Bezeichnung „Curcumin“. Es ist in vielen Fällen nicht definiert, ob es sich bei der Bezeichnung „Curcumin“ um ein Synonym für diverse Curcuminoide handelt, bzw. die Anteile der verschiedenen Curcuminoide sind nicht angeführt. (Nelson et al., 2017)
Eine in-vivo-Studie aus dem Jahr 2007 stellte mithilfe von Multiphoton Mikroskopie bei transgenen APP Mäusen nach i.v. Injektion von Curcumin über 7 Tage fest, dass Curcumin die Blut-Hirn-Schranke überwinden konnte und sich an bestehende Amyloid-Ablagerungen anheftete. (Garcia-Alloza et al., 2007)
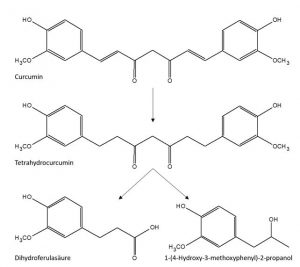
Abb.3: Curcumin-Metabolismus in einem menschlichen Fäkal-Fermentationsmodell (nach Tan et al., 2015)
Neuronale Entzündungshemmung und ß-Amyloid-Plaques
In den letzten Jahren wurden eine Reihe von pharmakologischen Studien durchgeführt, die Hinweise darauf liefern, dass Kurkuma-Präparate vor allem in der Alzheimer-Prävention von Nutzen sein könnten, aufgrund ihrer entzündungshemmenden Eigenschaften und der Fähigkeit senile Plaques im Gehirn zu reduzieren.
Neuronale Entzündungsvorgänge können zu Depressionen führen. Bei einer in-vivo-Studie verbesserte die Langzeitanwendung von Curcumin (Sigma, 40 mg/kg, i. p. (intraperitoneal), 5 Wochen) depressionsartiges Verhalten, verminderte die Expression des Entzündungsfaktors Interleukin-1ß (IL-1ß) und hemmte somit die Apoptose der Neurone im ventromedialen präfrontalen Cortex bei Ratten, die chronischem Stress (CUMS = chronic unpredictable mild stress) ausgesetzt waren. Ob und in welchem Ausmaß andere Curcuminoide in der getesteten Probe ebenfalls enthalten waren wird nicht beschrieben. Eine Überaktivierung von IL-1ß bewirkt die Phosphorylierung von p38-mitogenaktivierten Proteinkinasen (MAPK) und führt somit zu neuronaler Apoptose. Dieser Vorgang kann durch Curcumin unterbunden werden. Somit wirkt Curcumin neuroprotektiv, indem es vor IL-1ß-induzierter neuronaler Apoptose schützt. (Fan et al., 2018)
Der Stoffwechselpfad IL-1ß/p38 MAPK scheint in der Pathologie von Morbus Alzheimer eine Rolle zu spielen (Tsai, 2017).
Um die Bioverfügbarkeit der Curcuminoide zu verbessern und deren neuroprotektive Eigenschaften zu untersuchen, wurden mithilfe von Nanopartikel-Technologie Curcuminoid Submikron Partikel (CSP) mit einer durchschnittlichen Größe von 60 nm hergestellt. Diese wurden aus einer 10%igen wässrigen Curcuminoid-Lösung angefertigt, die sowohl Curcumin (83,56% der Curcuminoide) als auch Monodesmethoxycurcumin (14,13% der Curcuminoide) und Bisdesmethoxycurcumin (2,31% der Curcuminoide) beinhaltete. In vitro konnte man feststellen, dass CSP eine neuroprotektive Wirkung auf mit oligomeren Aß (ß-Amyloid-Peptiden) behandelte menschliche Neuroblastomzellen hat. Die Überlebensrate der Zellen, denen 5 μM CSP verabreicht wurden war größer als die der Zellen, die mit 5μM nicht submikronisierten Curcuminoiden (mittlerer Durchmesser = 5140 nm) behandelt wurden. In-vivo wurde in der selben Studie bei männlichen Mäusen eine bis zu 35-fach höhere Bioverfügbarkeit von CSP festgestellt im Vergleich zu nicht submikronisierten Curcuminoiden bei einer Dosis von 2,5 g pro kg. Bei der Bestimmung der Bioverfügbarkeit wurden die Plasmaspiegel der Curcuminoide durch HPLC Analyse erfasst, allerdings fehlen in der Studie nähere Angaben zur Analyse. CSP wurde dann bei transgenen Mäusen mit induziertem, verändertem ß-Amyloid-Präcursor-Protein (APP) in-vivo eingesetzt, um neuroprotektive Effekte zu untersuchen. Bei den mit CSP behandelten Mäusen verbesserte sich signifikant das räumliche Gedächtnis, außerdem kam es zu einer signifikanten Verbesserung der Leistungsfähigkeit, sowie von Defiziten des Erinnerungsvermögens. Bezüglich Angst-ähnlichem Verhalten und beim Bewegungsapparat der transgenen Mäuse zeigten sich jedoch keine Veränderungen. Reaktive Astrozyten führen bei Morbus Alzheimer unter anderem zu einem Ungleichgewicht der Neurotransmitter und in weiterer Folge zu Neurodegeneration. CSP konnte die Astrozyten-Aktivierung hemmen, wodurch es zu einer Verminderung der neurologischen Entzündungsvorgänge kam. Außerdem konnte eine Reduktion der Amyloid-Plaques festgestellt werden und die Phagozytose zur Bereinigung von neurotoxischem Aß42 wurde bei APP/CSP Mäusen im Hippocampus angekurbelt, im Gegensatz zu den APP Mäusen, denen kein CSP verabreicht wurde. Calzium-bindende Proteine, wie Calbindin-D28k regulieren die Calzium-Homöostase und schützen die Neurone vor Calzium-vermittelter Neurotoxizität. Es bestand ein Zusammenhang zwischen dem Untergang von Calbindin-D28k und Störungen der Merkfähigkeit bei den APP Mäusen. Durch CSP konnte die Reduktion von Calbindin-D28k im Hippocampus der APP Mäuse abgeschwächt werden. (Tai et al., 2018)
Den transgenen Mäusen wurde eine Dosis von 187,5 mg/kg CSP pro Tag verabreicht, was einer Dosis von 15,2 mg/kg pro Tag beim Menschen entsprechen würde. Um die gleichen neuroprotektiven Effekte beim Menschen zu erzielen, wird eine Dosis von ca. 912 mg von CSP für eine 60 kg schwere Person empfohlen, was sich innerhalb der ESCOP-Dosisgrenze für Curcuminoide pro Tag befindet. (European Scientific Cooperative on Phytotherapy, 2009, Tai et al., 2018)
Zudem wurden Untersuchungen bezüglich Genotoxizität und biologischer Sicherheit (akut (28 Tage) und chronisch (90 Tage)) von CSP durchgeführt. Es konnten keine Hinweise auf Toxizität bzw. Genominstabilität gefunden werden und es wurden keine Nebenwirkungen dokumentiert. (Tai et al., 2018)
In einer in-vivo Studie von Sundaram et al. (2017) konnte festgestellt werden, dass eine Behandlung mit Curcumin p25-assoziierte neuronale Entzündungsvorgänge bei transgenen Mäusen, die p25 überexprimieren (p25Tg mice), hemmt. Das Proteinfragment P25 entsteht durch die Spaltung des Cdk5 (Cyclin-abhängige Kinase 5) Aktivatorproteins P35 und fördert die Freisetzung von Cdk5, die wiederum eine bedeutende Rolle bei der Bildung von hyperphosphorylierten Tau-Proteinen bzw. ß-Amyloid-Plaques und damit bei der Pathogenese von Morbus Alzheimer spielt.
Einerseits konnte bei den transgenen Mäusen, denen Curcumin verabreicht wurde, eine signifikante Reduktion der durch p25-Überexpression induzierten Astrozyten-Aktivierung im Kortex und im Hippocampus, sowie eine verminderte Freisetzung entzündungsfördernder Zytokine festgestellt werden, im Gegensatz zur Kontrollgruppe. Andererseits konnte eine Verbindung zwischen der Hemmung neuronaler Entzündungsvorgänge und dem verlangsamten Fortschreiten p25-induzierter neurodegenerativer Prozesse erkannt werden, was auch in weiterer Folge der Grund für die beobachtete Verbesserung der kognitiven Beeinträchtigungen bei den p25Tg Mäusen sein könnte. Die Ergebnisse zeigten somit, dass eine frühzeitige Hemmung der neuronalen Entzündungsvorgänge womöglich das Fortschreiten pathogener Prozesse bei Mb. Alzheimer verlangsamen kann. Der Mechanismus, wie es zur Reduktion der Tau-Hyperphosphorylierung sowie der ß-Amyloid Plaques kommt, konnte jedoch noch nicht vollständig erfasst werden. Den transgenen p25 Mäusen wurden über 12 Wochen hindurch täglich 4g/kg (davon 0,8 g/kg Curcumin) einer festen Lipid-Curcumin-Partikel Zubereitung (Longvida®) verabreicht. Unter Berücksichtigung des Umrechnungsfaktors der Studie von Tai et al., 2018 entspricht die verabreichte Curcuminoid-Dosis etwa 67 mg/kg Curcuminoide beim Menschen. Wenn ein Gehalt von 2% Curcuminoiden im Curcuma-Rhizom angenommen wird, liegt die Dosierung somit deutlich über der von der ESCOP empfohlenen Tagesdosis beim Menschen (bis zu 3 g Droge).
In einigen sowohl pharmakologischen als auch klinischen Studien (siehe Gota et al., 2010) konnte eine erhöhte Bioverfügbarkeit dieser festen Lipid-Curcumin-Partikel-Zubereitung nachgewiesen werden, womöglich aufgrund der verringerten Partikelgröße sowie der Lipid-Ummantelung, die einen direkten Transport über das lymphatische System ermöglicht. (Sundaram et al., 2017)
Die nachfolgend beschriebenen klinischen Studien betreffen Untersuchungen zur Bioverfügbarkeit von Kurkuma sowie ZNS Wirkungen.
Bioverfügbarkeit
In einer klinischen Studie von Gota et al. (2010) bezüglich Bioverfügbarkeit und Verträglichkeit einer festen Curcumin-Lipid-Formulierung (SLCP = solid lipid curcumin particle) (Longvida®) konnte man deutlich erhöhte Curcumin-Plasmaspiegel feststellen, im Vergleich zum nicht modifizierten 95%igen Curcuminoidextrakt (Mindestgehalt 60% Curcumin). Die Lipid-hältige Formulierung bestand aus Curcuma-Wurzelextrakt gemischt mit Sojalecithin, Docosahexaensäure, Stearinsäure, sowie Ascorbinsäureester und inerten Ingredienzien. Diese Formulierung wies einen Curcumingehalt von 20-30% auf.
Ein Teil der Untersuchung wurde als eine Einzeldosis-Doppelblind-Crossover-Studie durchgeführt. Dabei wurden die pharmakokinetischen Parameter der beiden Kurkuma-Zubereitungen miteinander verglichen. 6 gesunden männlichen indischen Probanden zwischen 18 und 40 Jahren wurden jeweils in Kapselform 650 mg der Lipid-haltigen Formulierung (mit 130-195 mg Curcumin) und der nicht modifizierten Formulierung (mit > 390 mg Curcumin) oral verabreicht, nach einer Wash-Out Periode von 2 Wochen. Vor und jeweils eine, 2, 3, 4, 6 und 8 Stunden nach den Einnahmen wurden bei den Probanden Blutproben entnommen und mittels HPLC-PDA ausgewertet. Trotz der höheren Dosis an Curcumin lag die freie Curcumin-Plasmakonzentration bei den Probanden nach Einnahme der 95%igen Curcuminoidextrakts unter der Nachweisgrenze. Im Vergleich dazu konnte bei den Probanden nach Einnahme der SLPC eine Cmax von 22,43 ± 1,92 ng/mL (tmax 2,40 ± 0,44) detektiert werden.
Andererseits wurden 11 Osteosarkom-PatientInnen (davon 7 Männer und 4 Frauen) indischer Abstammung im Alter zwischen 12 und 60 Jahren 2000 (n=4), 3000 (n=3) bzw. 4000 mg (n=4) der SLCP Formulierung verabreicht und ebenfalls die pharmakokinetischen Parameter gemessen. Die hohen Dosen wurden aufgrund von vorangegangenen pharmakokinetischen Studien an Tieren und gesunden ProbandInnen gewählt, die genauen Daten dazu sind jedoch nicht in der Studie enthalten. Man konnte feststellen, dass die Plasmakonzentrationen an freiem Curcumin bei Analyse ohne Glucuronidase-Zusatz trotz der bis zu 6-fach erhöhten Dosis an SLCP im Vergleich zu den gesunden ProbandInnen nicht im gleichen Maß anstiegen (Cmax nach 4000 mg Dosis = 41,15 ± 8,94 ng/ mL). Dies wirft die Frage nach einer komplexeren Absorptionskinetik auf, bzw. einer unterschiedlichen Absorption bei gesunden ProbandInnen und KrebspatientInnen auf. Angaben zu weiterer Medikation während der Studie wurden nicht gemacht, ebenso liegen keine Daten zu Leberenzymspiegeln vor. Es kam sowohl bei den Osteosarkom-PatientInnen als auch bei den gesunden Probanden zu keinen unerwünschten Nebenwirkungen. Diese Studie legt die Grundlage für weitere Untersuchungen in diesem Bereich mit einer größeren Anzahl an Testpersonen und einer Langzeit-Verabreichung der SLCP-Formulierung.
| Parameter | 650 mg SLCP Dosis | 650 mg 95%iger Curcuminoidextrakt Dosis |
| Cmax (ng/mL) | 22,43 ± 1,92 | <1 |
| tmax (h) | 2,40 ± 0,44 | k. A. |
| AUC (0-f) (ng/mL * h) | 95,26 ± 4,62 | k. A. |
| AUC (0-inf) (ng/mL * h) | 178,44 ± 27,08 | k. A. |
| t1/2 (h) | 7,46 ± 2,43 | k. A. |
| Kel (per h) | 0,10 ± 0,03 | k. A. |
Tabelle 3 aus der Studie: Pharmakokinetische Daten der gesunden ProbandInnen (n=6) nach oraler Verabreichung von 650 mg der SLCP Formulierung und von 650 mg des 95%igen Curcuminoidextrakts (alle Daten angegeben als Mittelwert ± Standardfehler, Cmax = maximale Plasmakonzentration, tmax = Zeit bis zur maximalen Plasmakonzentration, AUC = Fläche unter der Kurve, t1/2 = Halbwertszeit, Kel = Eliminationskonstante, k. A. = keine Angabe)
(Gota et al., 2010)
ZNS-Wirkungen
Die tägliche Einnahme von Curcumin in bioverfügbarer Form (Theracumin® mit 90 mg Curcumin, 2 mal täglich, keine weiteren Angaben zur Zubereitung) über 18 Monate verbesserte die Gedächtnisleistung bei nicht-dementen PatientInnen im Alter zwischen 51 und 81 Jahren. Es handelte sich um eine Placebo-kontrollierte Doppelblindstudie, bei der 40 Personen teilnahmen. Die Ergebnisse zeigten bei den Testpersonen eine Verbesserung des Lang- und Kurzzeitgedächtnisses, sowie des visuellen Gedächtnisses und der Aufmerksamkeit im Vergleich zur Placebo-Gruppe. Außerdem war eine stimmungsaufhellende Wirkung bemerkbar. Mithilfe einer speziellen Positron-Emissionstomographie konnte eine Reduktion von Eiweißablagerungen wie senilen Plaques und Neurofibrillen überwiegend in der Amygdala sichtbar gemacht werden. Eine Reduktion von ß-Amyloid- bzw. hyperphosphorylierten Tau-Ansammlungen in verschiedenen Hirnregionen kann mit einer verbesserten Hirnleistung in Verbindung gebracht werden. (Small et al., 2018)
Bei einer weiteren randomisierten, Placebo-kontrollierten Doppelblind-Studie wurden sowohl akute als auch chronische Wirkungen eines bioverfügbaren Curcumin-Präparats (Longvida®) auf die Gedächtnisleistung, Stimmung und einige Blut-Biomarker (Lipidprofil, Entzündungsmarker, hämatologische Tests bezüglich der Nieren- und Leberfunktion) getestet. An der Studie nahmen 60 gesunde Testpersonen im Alter zwischen 60 und 85 Jahren teil. Die Untersuchungen hinsichtlich der akuten Effekte von Curcumin fanden eine Stunde und 3 Stunden nach Verabreichung einer einzelnen Dosis des Kurkuma-Präparats (400 mg mit ca. 80 mg Curcumin in Solid-Lipid-Nanopartikel) statt, die Untersuchungen zur chronischen Wirkung über 4 Wochen. Zusätzlich wurde noch während der chronischen Therapie die akute Wirkung getestet, indem 1 und 3 Stunden nach jeder Einnahme über 4 Wochen Untersuchungen durchgeführt wurden. Die Untersuchungen zeigten bei der Versuchsgruppe bereits eine Stunde nach der Einnahme signifikante Verbesserungen des Arbeitsgedächtnisses und der Aufmerksamkeit der Testpersonen, im Vergleich zur Kontrollgruppe. Auch im weiteren Verlauf der Studie machte sich eine positive Wirkung auf das Arbeitsgedächtnis, aber auch auf die Gemütslage bemerkbar. Chronische stimmungsaufhellende Wirkungen von Curcumin waren vor allem verringerte Müdigkeit und erhöhte Belastbarkeit gegenüber kognitivem Stress. Die Biomarker betreffend, konnte eine Reduktion des Gesamt-Cholesterinwertes, sowie des LDL-Wertes, festgestellt werden. (Cox et al., 2015)
Im Rahmen einer randomisierten, placebokontrollierten Doppelblindstudie aus dem Jahr 2019 zeigten sich bei gesunden Personen nach 12 Wochen signifikante Verbesserungen des Arbeitsgedächtnisses. Bereits nach 4 Wochen kam es außerdem zu verminderter Erschöpfung kombiniert mit einer Verbesserung der Stimmung. Untersucht wurde die kognitive Leistung mit einem Schwerpunkt auf Gedächtnisfunktionen des Hippocampus. Es wurde auch auf eine Veränderung der kardiovaskulären Funktion und andere nicht näher definierte Blutbiomarker getestet, wobei keine Unterschiede zwischen der Versuchsgruppe und der Kontrollgruppe zu beobachten waren. Es nahmen 80 Personen im Alter zwischen 50 und 80 Jahren an der Studie teil und es wurde über 12 Wochen ein gut bioverfügbarer Kurkuma-Extrakt (Longvida®, 400 mg täglich, davon 80 mg Curcumin) verabreicht. (Scholey et al., 2019)
Im Jahr 2012 wurde eine klinische Studie zur Wirkung und Verträglichkeit eines Kurkuma-Präparats (Curcumin C3 Komplex®) bei 66 an gering bis mäßig an Mb. Alzheimer erkrankten Personen mit einem Durchschnittsalter von 73,5 Jahren durchgeführt. Es handelte sich um eine 24-wöchige randomisierte, Placebo-kontrollierte Doppelblindstudie mit einer entblindeten Verlängerung auf 48 Wochen. Unter Curcumin C3 Komplex® versteht man einen orange-gelben kristallinen Pflanzenpulverextrakt in Kapseln. Dieser besteht zu 95% aus Curcuminoiden, davon 70-80% Curcumin, 15-25% Monodesmethoxycurcumin und 2,5-6,5% Bisdesmethoxycurcumin, wovon den Alzheimer-erkrankten Personen 2 bzw. 4 g pro Tag verabreicht wurden, aufgeteilt auf 2 Dosen. Im Allgemeinen wurde das Kurkumapräparat gut vertragen, 3 der 24 Personen der Versuchsgruppe stiegen jedoch vorzeitig aus der Studie aus, aufgrund von gastrointestinalen Beschwerden, wie Diarrhö. Im Gegensatz zu den in-vitro und in-vivo-Studien konnten bei dieser Studie sowohl bei der Gruppe mit 2 g als auch bei der mit 4 g des Kurkuma-Präparats pro Tag keine klinischen und biochemischen Hinweise auf die Wirksamkeit gegen Mb. Alzheimer gefunden werden. Das verabreichte Kurkuma-Präparat wies jedoch mit Curcumin-Plasmaspiegeln von durchschnittlich 7,76 ± 3,23 ng/mL eine sehr geringe Bioverfügbarkeit auf. Auch die kleine Anzahl an Testpersonen könnte damit zusammenhängen, dass kein Effekt nachgewiesen werden konnte. (Ringman et al., 2012)
Diese Ergebnisse spiegeln sich auch in einer randomisierten Placebo-kontrollierten Studie aus dem Jahr 2008 wider. Es konnte keine Verbesserung der Gedächtnisleistung durch Einnahme von Curcuminoiden bei 34 bereits an Alzheimer-Demenz erkrankten PatientInnen nachgewiesen werden, von denen 27 die Studie abgeschlossen haben (8 Testpersonen Placebo, 8 Testpersonen 1g Dosierung, 11 Testpersonen 4g Dosierung). Die Untersuchung lief über einen Zeitraum von 6 Monaten und bei fortlaufender bereits bestehender Alzheimer-Therapie, wie zum Beispiel Ginkgo Blatt-Extrakt. Ein Teil der ProbandInnen (genaue Anzahl der Testpersonen nicht bekannt) bekam den Curcuminoid-Extrakt in Kapselform verabreicht und ein Teil in Pulverform. Die unterschiedlichen Darreichungsformen wurden jedoch von unterschiedlichen Firmen bezogen und wurden nicht auf ihren genauen Gehalt überprüft. Der durchschnittliche Plasmaspiegel der Curcuminoide lag bei 490 nM. Nachdem auch bei der Placebogruppe während der Studiendauer keine Verschlechterung der geistigen Leistungsfähigkeit nachgewiesen werden konnte, war eine positive Wirkung von Curcuminoiden im Vergleich zu Placebo kaum feststellbar. (Baum et al., 2008)
Weitere gesundheutsfördernde Wirkungen
Bei einer 4-wöchigen placebokontrollierten Studie zeigten sich eine Reihe gesundheitsfördernder Wirkungen eines niedrig-dosierten Lipid-ummantelten Curcumin-Präparats (Longvida®, 400 mg mit 80mg Curcumin pro Tag). Einerseits wurde im Vergleich zur Placebogruppe bei der Versuchsgruppe ein erniedrigter Plasma-Triglyzeridwert festgestellt, im Gegensatz zu anderen Studien konnten jedoch keine Veränderungen der Cholesterin-Werte gemessen werden. Weiters kam es zu einer Steigerung des NO-Plasmaspiegels, sowie zu einer Senkung der Plasmakonzentration der löslichen Adhäsionsmoleküle sICAM. Dies hat potentiell einen positiven Einfluss auf Blutdruck und die Entstehung von Atherosklerose, wobei Blutdruck und Atheroskleroseablagerungen in dieser Studie nicht gemessen wurden. Andererseits zeigte sich eine leichte Verringerung der ß-Amyloidplaques im Plasma, was mit Alzheimer-präventiver Wirkung in Verbindung gebracht werden kann. Außerdem war eine Senkung der alpha-Amylaseaktivität im Speichel bemerkbar, was auf eine reduzierte Aktivität des sympathischen Stress-Systems hinweist. Eine weitere gesundheitsfördernde Wirkung des Curcumin-Präparats im Gegensatz zum Placebo war eine Senkung der Plasmaaktivität von Alanin-Aminotransferase, die ein Marker für Leberschäden ist. Es nahmen 38 gesunde Personen in einem Alter zwischen 40 und 60 Jahren an der Studie teil. (DiSilvestro et al., 2012)
Schlussfolgerung und Ausblick
Alles in allem kann man sagen, dass die bisher durchgeführten klinischen Studien an Erkrankten keine Hinweise auf therapeutische Effekte von Kurkuma auf Morbus Alzheimer brachten. Klinische Studien an Gesunden wiesen jedoch auf eine mögliche positive Wirkung von Kurkuma-Präparaten vor allem zur Alzheimer-Prävention, eine Steigerung der Gedächtnisleistung und stimmungsaufhellende Effekte hin. Um dies zu bestätigen, müssen noch mehr klinische Studien mit einer größeren Anzahl an Testpersonen und über einen längeren Zeitraum durchgeführt werden. Außerdem sollten den Testpersonen besser bioverfügbare Arzneiformen, wie mithilfe von Nanopartikeltechnologie und Lipidummantelung modifizierte Kurkuma-Präparate, verabreicht werden, um aussagekräftigere Ergebnisse zu bekommen. Zudem wäre es eine Möglichkeit, in Zukunft auch den Stellenwert der Curcuminoid-Metaboliten in der Wirksamkeit von Kurkuma genauer zu untersuchen. Zu bedenken gilt, dass es immer noch Verbesserungsmöglichkeiten bezüglich der Bioverfügbarkeit bei den Darreichungsformen von Kurkuma-Präparaten gibt und dass als Folge der höheren Curcumin-Plasmaspiegel, die durch verbesserte Arzneiformen erreicht werden, auch die Sicherheit bezüglich Toxizität und Mutagenität gewährleistet sein muss. Weitere Studien sollten untersuchen, ob Curcuminoide auch beim Menschen die Blut-Hirn-Schranke durchdringen können, bisher gibt es nur erste Hinweise aus Tierversuchen. Eine klarere Definition des Begriffes „Curcumin“ und die genauen Reinheits- bzw. Verhältnisangaben der einzelnen Curcuminoide in den verabreichten Kurkuma-Präparaten wären bei zukünftigen Studien ebenfalls von Vorteil und würden die Vergleichbarkeit der Studien untereinander wesentlich erleichtern.
Über Morbus Alzheimer
Morbus Alzheimer gehört zu den neurodegenerativen Erkrankungen und ist die häufigste Ursache von Demenz. Mit zunehmendem Alter nimmt die Erkrankungswahrscheinlichkeit zu, mit einem Alter von 85 Jahren leiden bis zu 30% der Personen an Morbus Alzheimer.
Der Krankheitsverlauf ist schleichend. Zu Beginn leiden die Erkrankten aufgrund von Veränderungen vor allem im Hippocampus an Gedächtnis- und Wortfindungsstörungen. Nach und nach kommt es zu Verlust von räumlicher und zeitlicher Orientierung und schlussendlich gehen die meisten kognitiven Fähigkeiten verloren. Außerdem kommt es im Spätstadium häufig zu Myoklonien (spontanen Muskelzuckungen) und Krampfanfällen. Die PatientInnen sind zudem oft depressiv und unruhig.
Der Grund für den zunehmenden Verlust der Gehirnfunktionen ist, dass es im Laufe der Alzheimer-Erkrankung zu einer ausgeprägten Abnahme von weißer und grauer Gehirnsubstanz (Atrophie) kommt. Vor allem cholinerge Neurone sind von der Atrophie betroffen, wodurch es zu einem Mangel des wichtigen Transmittermoleküls Acetylcholin kommt. Durch die Atrophie sind breite Furchen und erweiterte Hirnventrikel im Gehirn der Alzheimer-Erkrankten erkennbar.
Auf histologischer Ebene kommt es zu zwei wesentlichen Arten von Eiweißablagerungen im Gehirn. Zum einen lassen sich extrazellulär sogenannte neuritische Plaques nachweisen. Darunter versteht man Ablagerungen von neurotoxischem ß-Amyloid. Diese Polypeptide entstehen durch fehlerhafte Spaltung des ß-Amyloid-Präcursor-Proteins (APP), welches an der Synapsenbildung beteiligt ist. Im Normalfall kommt es nicht zu Ablagerungen des APP, da durch eine korrekte Spaltung (über den nicht amyloidogenen Weg) lösliche Proteine mit neuroprotektiven Eigenschaften gebildet werden. Bei der Spaltung über den amyloidogenen Weg hingegen kommt es zur Bildung von ß-Amyloid, das zwar in monomerer Form keine Neurotoxizität zeigt, jedoch stark zur Oligomerisierung neigt. Die Oligomere und die Amyloidfibrillen (Plaques) werden mit entzündlichen und neurodegenerativen Prozessen in Verbindung gebracht. (LaFerla et al., 2007, Müller et al., 2017)
Nach bisherigem Wissensstand weiß man, dass die ß-Amyloidpeptide mit Rezeptoren (z.B. Scavenger-Rezeptor, RAGE (receptor for advanced glycation end products)) an der Zelloberfläche der Neurone in Wechselwirkung treten, wodurch Sauerstoffradikale gebildet werden, die in weiterer Folge die neuronale intrazelluläre Ca2+ Konzentration erhöhen. Sowohl Sauerstoffradikale als auch Ca2+ fördern neuronale Apoptose. Auch die Rezeptoren auf Mikrogliazellen werden durch senile Plaques aktiviert, was die Bildung und Ausschüttung von entzündungsfördernden Zytokinen, Wachstumsfaktoren, Tumornekrosefaktoren sowie NO und Prostaglandinen zur Folge hat. Bei der dadurch entstehenden Entzündung kommt es ebenfalls zum Untergang von Neuronen.
Zum anderen kommt es bei Morbus Alzheimer intrazellulär zur Bildung von fehlgefalteten neurofibrillären Konglomeraten, sogenannten Tangles. Diese bestehen aus hyperphosphorylierten Tau-Proteinen. Tau-Proteine sind am Aufbau des Zytoskeletts beteiligt und somit für einen funktionierenden Transport innerhalb der Nervenzellen notwendig. Die unlöslichen Tangles schädigen zytoplasmatische Funktionen und beeinträchtigen den axonalen Transport, was in weiterer Folge zu neuronalem Zelltod führen kann. Nach neueren Erkenntnissen könnten die ß-Amyloidablagerungen die Ursache für die Hyperphosphorylierung der Tau Proteine darstellen. Diese Hyperphosphorylierung hat zur Folge, dass es bei nativen Tau-Monomeren nach vorgegebenen Mustern ebenfalls zu eine Fehlfaltung kommt, wodurch sich neue pathologische Tau-Aggregate bilden. Tau-bedingte pathologische Veränderungen können sich so auch über Synapsen hinweg in weiter entfernte Neurone ausbreiten. Die Rolle dieser fehlgefalteten Tau-Proteine wird mit jener von Prionen verglichen. (Long, Holtzman, 2019, Mohandas et al., 2009)
Die Ursachen für Morbus Alzheimer sind noch nicht vollständig geklärt, aber einige Risikofaktoren sind bekannt. Unter anderem wird Mb. Alzheimer durch eine genetische Veranlagung begünstigt. Dabei handelt es sich um einen autosomal-dominanten Erbgang und es kommt schon früh zur Erkrankung. Im Allgemeinen sind häufig genetische Faktoren der Grund für die Erkrankung. Insbesondere Mutationen auf dem Chromosom 21, die zu Tau-Protein- und ß-Amyloidmutationen führen, werden für die Entwicklung von Mb. Alzheimer verantwortlich gemacht. Das ist auch der Grund, weshalb Menschen mit Trisomie 21 oft schon sehr früh an Mb. Alzheimer erkranken.
Nach dem momentanen Wissensstand ist keine Heilung der Krankheit möglich. Es gibt jedoch Antidementiva, die zwar den Krankheitsverlauf nicht beeinflussen können, aber die Symptome zumindest teilweise verbessern können.
Bei leichter bis mittelschwerer Alzheimerdemenz werden durch die beeinträchtigte cholinerge Erregungsübertragung vor allem Acetylcholinesterasehemmer eigesetzt, wie Donepezil, Galantamin oder Rivastigmin. Forschungen konnten durch die Behandlung eine Verbesserung des Allgemeinzustands, sowie einen positiven Einfluss auf die kognitiven Funktionen und die Fähigkeit zur Verrichtung von Alltagsaktivitäten feststellen. Die Acetylcholinesterasehemmer werden in der höchsten verträglichen Dosis fortlaufend gegeben. Vom Absetzen der Arzneimittel wird abgeraten, da es mit einer klinischen Verschlechterung in Verbindung stehen kann. Vor allem Donepezil und Galantamin werden off-label bis ins schwere Stadium verabreicht, auch in Kombination mit Memantin, einem nicht-kompetitiven NMDA-Rezeptor-Antagonisten. Memantin soll die Überstimulierung von NMDA-Rezeptoren und die damit verbundene Überladung von Nervenzellen mit Calciumionen verhindern. Zudem kann bei leichter bis mittelschwerer Demenz auch Ginkgo-biloba-Extrakt EGb 761 verordnet werden. Der Wirkmechanismus des Phytopharmakons ist nicht vollständig bekannt. Als Alzheimer-Prävention wird es nicht empfohlen. In dieser Hinsicht wird vor allem eine Verminderung der Risikofaktoren wie Hypertonie, Diabetes mellitus, Hyperlipidämie und Adipositas empfohlen durch eine gesunde Ernährung, sowie körperliche Bewegung und ein rauchfreies, aktives Leben mit geistiger und sozialer Betätigung.
Bei der Therapie von mit Mb. Alzheimer verbundenen Symptomen wie Agitation und Aggressivität ist Vorsicht geboten. Wegen einer beschleunigten Verschlechterung kognitiver Fähigkeiten sollen Antipsychotika und Benzodiazepine zurückhaltend eingesetzt werden. Ebenso sollte der Einsatz von Antipsychotika mit anticholinergen Nebenwirkungen und tricyclische Antidepressiva vermieden werden. Behandlungsalternativen wären das auch bei psychomotorischer Unruhe eingesetzte Risperidon, außerdem Aripiprazol (off-label), Carbamazepzin und evtentuell Citalopram (off-label).
(Geisslinger et al., 2019, Silbernagl, Lang, 2009, Vaupel et al., 2015)





