Übersicht
Allein im botanischen Namen Allium sativum, welcher sich vom keltischen Wort „all“- brennend, stechend, sowie vom lateinischen Wort „sativum“ – kultiviert ableitet, steckt die Information, dass Knoblauch eine Kulturpflanze ist. Zudem lassen sich die Eigenschaften des charakteristischen brennenden, scharfen Geschmacks und Geruchs des Knoblauchs im Namen wiederfinden [3, 4].
Die heilenden Kräfte des Knoblauchs sind schon seit tausenden Jahren bekannt. Verwendet wurde Knoblauch als Gewürz zum Kochen, in der Medizin, sowie für spirituelle Zwecke zur Abwehr von bösen Geistern, Dämonen und Vampiren. Schon von jeher wusste man über die antibakteriellen, lipidsenkenden und antihypertensiven Wirkungen Bescheid und verwendete Knoblauch zur Behandlung von Ohren- und Bauchschmerzen, Lepra, Schwerhörigkeit, schwerer Diarrhö, Obstipation, zum Fieber senken, sowie zur Abwehr von Infektionen aller Art durch Parasiten [4, 5].
Droge
Allii sativi bulbi pulvis (Knoblauchpulver)
Die geschnittenen, gefriergetrockneten oder bei einer Temperatur von höchstens 65 °C getrockneten und pulverisierten Zwiebeln von Allium sativum L., welche bezogen auf die getrocknete Droge einen Gehalt von mindestens 0,45% Allicin aufweisen [2].
Nachweise:
Die Monografie entstand mit freundlicher Genehmigung nach einer Diplomarbeit von Mag. pharm. Klara Loibnegger (2017).
Literaturverzeichnis
1. Hänsel R, Keller K, Rimpler H, Schneider G (Hrsg) (1992) Hagers Handbuch der pharmazeutischen Praxis. Drogen A-D, 5. Aufl. Springer Berlin Heidelberg, Berlin, Heidelberg, s.l.
2. Europäisches Arzneibuch – Pharmacopoeia Europaea. Knoblauchpulver – Allii sativi bulbi pulvis. 8. Ausgabe, Grundwerk 2014
3. Omar SH, Al-Wabel NA (2010) Organosulfur compounds and possible mechanism of garlic in cancer. Saudi Pharm J 18(1):51–58. doi:10.1016/j.jsps.2009.12.007
4. Kemper KJ (Revised 2000) Garlic (Allium sativum). The Longwood Herbal Task Force. Revised March 8, 2000. Available at: http://www.longwoodherbal.org/garlic/garlic.pdf. Accessed 15/08/12
5. European Medicines Agency, Committee on Herbal Medicinal Products (2016) Assessment report on Allium sativum L., bulbus. EMA/HMPC/7686/2013
6. WHO Monographs on selected medicinal plants. Volume 1. Bulbus Allii Sativi. World Health Organisation: Geneva; 1999
7. Wichtl M, Brinckmann JA, Czygan F-C (Hrsg) (2004) Herbal drugs and phytopharmaceuticals. A handbook for practice on a scientific basis, 3. Aufl. Medpharm, Stuttgart
8. ESCOP Monographs – The Scientific Foundation for Herbal Medicinal Products. Allii sativi bulbus – Garlic. Second Edition. Thieme Verlag: Stuttgart; 2003
9. Block E (1985) The Chemistry of Garlic and Onions. Sci Am 252(3):114–118. doi:10.1038/scientificamerican0385-114
10. Richard S. Rivlin (2006) Significance of Garlic and Its Constituents in Cancer and Cardiovascular Disease. Is Garlic Alternative Medicine? J Nutr 136:713S–715S
11. European Medicines Agency, Committee on Herbal Medicinal Products (2016) European Union herbal monograph on Allium sativum L. bulbus. EMA/HMPC/7685/2013
12. Borrelli F, Capasso R, Izzo AA (2007) Garlic (Allium sativum L.). Adverse effects and drug interactions in humans. Mol Nutr Food Res 51(11):1386–1397. doi:10.1002/mnfr.200700072
13. Tattelman E (2005) Health effects of garlic. Am Fam Physician 72(1):103–106
14. Ma S, Yin J (2012) Anaphylaxis induced by ingestion of raw garlic. Foodborne Pathog Dis 9(8):773–775. doi:10.1089/fpd.2012.1133
15. Ackermann RT, Mulrow CD, Ramirez G, Gardner CD, Morbidoni L, Lawrence VA (2001) Garlic Shows Promise for Improving Some Cardiovascular Risk Factors. Arch Intern Med 161(6):813. doi:10.1001/archinte.161.6.813
16. Mennella JA, Beauchamp GK (1993) The effects of repeated exposure to garlic-flavored milk on the nursling’s behavior. Pediatr Res 34(6):805–808. doi:10.1203/00006450-199312000-00022
17. Leite PM, Martins MAP, Castilho RO (2016) Review on mechanisms and interactions in concomitant use of herbs and warfarin therapy. Biomed Pharmacother 83:14–21. doi:10.1016/j.biopha.2016.06.012
18. Saw JT, Bahari MB, Ang HH, Lim YH (2006) Potential drug–herb interaction with antiplatelet/anticoagulant drugs. Complementary Therapies in Clinical Practice 12(4):236–241. doi:10.1016/j.ctcp.2006.06.002
19. Macan H, Uykimpang R, Alconcel M, Takasu J, Razon R, Amagase H, and Niihara Y (2006) Aged Garlic Extract May Be Safe for Patients on Warfarin Therapy1. J Nutr 136:793S–795S
20. Awang DVC (2009) Tyler’s Herbs of Choice. The Therapeutic Use of Phytomedicinals, Third Edition. CRC Press
21. Rose KD, Croissant PD, Parliament, C.F. and Levin, M.B. (1990) Spontaneous Spinal Epidural Hematoma with Associated Platelet Dysfunction from Excessive Garlic Ingestion: A Case Report. Neurosurgery 26:880–882
22. Burnham BE (1995) Garlic as a possible risk for postoperative bleeding. Department of Plastic and Reconstructive Surgery 95(1):213
23. GERMAN K, KUMAR U, BLACKFORD HN (1995) Garlic and the risk of TURP bleeding. British Journal of Urology 76(4):518. doi:10.1111/j.1464-410X.1995.tb07766.x
24. Wang C-Z, Moss J, Yuan C-S (2015) Commonly Used Dietary Supplements on Coagulation Function during Surgery. Medicines (Basel) 2(3):157–185. doi:10.3390/medicines2030157
25. Piscitelli SC, Burstein AH, Welden N, Gallicano, Keith D. and Falloon, Judith (2002) The Effect of Garlic Supplements on the Pharmacokinetics of Saquinavir. Oxford Journals 34(2):234–238
26. Gallicano K, Foster B, Choudhri S (2003) Effect of short-term administration of garlic supplements on single-dose ritonavir pharmacokinetics in healthy volunteers. British Journal of Clinical Pharmacology 55(2):199–202. doi:10.1046/j.1365-2125.2003.01736.x
27. Nakagawa S, Masamoto K, Sumioyoshi H and Harada H. (1984) [Acute toxicity test of garlic extract]. The Journal of Toxicological Sciences 9(57-60)
28. Nwanjo, H. and Oze, G. (2006) Antiarrythmic And Anti-Hyperlipidaemic Potentials Of Aqueous Garlic Extract In Hypercholesterolaemic Rats. The Internet Journal of Nutrition and Wellness 3(2):1–5
29. Nakagawa S, Masamoto K, Sumioyoshi H, Kunihiro K and Fuwa T (1980) [Effect of raw and extracted-aged garlic juice on growth of young rats and their organs after peroral administration]. The Journal of Toxicological Sciences 5:91–112
30. Hammami I, Nahdi A, Mauduit C, Benahmed M, Amri M, Ben Amar A, Zekri S, El May A, El May MV (2008) The inhibitory effects on adult male reproductive functions of crude garlic (Allium sativum) feeding. Asian J Androl 10(4):593–601. doi:10.1111/j.1745-7262.2008.00358.x
31. Dixit VP, Joshi S (1982) Effects of chronic administration of garlic (Allium sativum Linn) on testicular function. Indian J Exp Biol 20(7):534–536
32. Hammami I, Amara S, Benahmed M, El May MV, Mauduit C (2009) Chronic crude garlic-feeding modified adult male rat testicular markers. Mechanisms of action. Reprod Biol Endocrinol 7:65. doi:10.1186/1477-7827-7-65
33. Hammami I, Nahdi A, Atig F, Kouidhi W, Amri M, Mokni M, May AE, May ME (2013) Effects of garlic fractions consumption on male reproductive functions. J Med Food 16(1):82–87. doi:10.1089/jmf.2011.0335
34. Abdelmalik SW (2011) Histological and ultrastructural changes in the adult male albino rat testes following chronic crude garlic consumption. Ann Anat 193(2):134–141. doi:10.1016/j.aanat.2010.12.003
35. Kasuga S, Uda N, Kyo E, Ushijima M, Morihara N, and Itakura Y. (2001) Pharmacologic activities of aged garlic extract in comparison with other garlic preparations. J Nutr 131(3):1080S–1084S
36. Khalil WKB, Ahmed KA, Park MH, Kim YT, Park HH, Abdel-Wahhab MA (2008) The inhibitory effects of garlic and Panax ginseng extract standardized with ginsenoside Rg3 on the genotoxicity, biochemical, and histological changes induced by ethylenediaminetetraacetic acid in male rats. Arch Toxicol 82(3):183–195. doi:10.1007/s00204-007-0237-y
37. Charles GD, Linscombe VA, Tornesi B, Mattsson JL, Gollapudi BB (2002) An in vitro screening paradigm for extracts of whole foods for detection of potential toxicants. Food and Chemical Toxicology 40(10):1391–1402. doi:10.1016/S0278-6915(02)00085-6
38. Abraham SK, Kesavan PC (1984) Genotoxicity of garlic, turmeric and asafoetida in mice. Mutation Research/Genetic Toxicology 136(1):85–88. doi:10.1016/0165-1218(84)90138-1
39. Varshney R, Budoff MJ (2016) Garlic and Heart Disease. J Nutr 146(2):416S–421S. doi:10.3945/jn.114.202333
40. Yeh Y-Y, Yeh S-M (1994) Garlic reduces plasma lipids by inhibiting hepatic cholesterol and triacylglycerol synthesis. Lipids 29(3):189–193. doi:10.1007/BF02536728
41. Gebhardt R (1993) Multiple inhibitory effects of garlic extracts on cholesterol biosynthesis in hepatocytes. Lipids 28(7):613–619. doi:10.1007/BF02536055
42. Gebhardt R, Beck H, Wagner KG (1994) Inhibition of cholesterol biosynthesis by allicin and ajoene in rat hepatocytes and HepG2 cells. Biochimica et Biophysica Acta (BBA) – Lipids and Lipid Metabolism 1213(1):57–62. doi:10.1016/0005-2760(94)90222-4
43. Orekhov AN, Tertov VV, Sobenin IA, Pivovarova EM (1995) Direct Anti-atherosclerosis-related Effects of Garlic. Annals of Medicine 27:63–65
44. Ali M, Al-Qattan KK, Al-Enezi F, Khanafer RM, Mustafa T (2000) Effect of allicin from garlic powder on serum lipids and blood pressure in rats fed with a high cholesterol diet. Prostaglandins Leukot Essent Fatty Acids 62(4):253–259. doi:10.1054/plef.2000.0152
45. Ismail MF, Gad MZ, Hamdy MA (1999) Study of the hypolipidemic properties of pectin, garlic and ginseng in hypercholesterolemic rabbits. Pharmacol Res 39(2):157–166. doi:10.1006/phrs.1998.0421
46. Abramovitz D, Gavri S, Harats D, Levkovitz H, Mirelman D, Miron T, Eilat-Adar S, Rabinkov A, Wilchek M, Eldar, Michael and Vered, Zvi (1999) Allicin-induced decrease in formation of fatty streaks (atherosclerosis) in mice fed a cholesterol-rich diet 10:515–519
47. Isensee H, Rietz B, Jacob R (1993) Cardioprotective actions of garlic (Allium sativum). Arzneimittelforschung 43(2):94–98
48. Kwon M-J, Song Y-S, Choi M-S, Park S-J, Jeong K-S, Song Y-O (2003) Cholesteryl ester transfer protein activity and atherogenic parameters in rabbits supplemented with cholesterol and garlic powder. Life Sciences 72(26):2953–2964. doi:10.1016/S0024-3205(03)00234-0
49. Sobenin IA, Andrianova IV, Lakunin KY, Karagodin VP, Bobryshev YV, Orekhov AN (2016) Anti-atherosclerotic effects of garlic preparation in freeze injury model of atherosclerosis in cholesterol-fed rabbits. Phytomedicine 23(11):1235–1239. doi:10.1016/j.phymed.2015.10.014
50. Al-Qattan KK, Alnaqeeb MA, Ali M (1999) The antihypertensive effect of garlic (Allium sativum) in the rat two-kidney–one-clip Goldblatt model. Journal of Ethnopharmacology 66(2):217–222. doi:10.1016/S0378-8741(98)00173-1
51. Brändle M, Makdessi S, Weber RK, Dietz K, Jacob R (1997) Prolongation of life span in hypertensive rats by dietary interventions. Effects of garlic and linseed oil. Basic Res Cardiol 92(4):223–232. doi:10.1007/BF00788517
52. Das I, Khan, Nusrat S. and Sooranna, Suren R. (1995) Potent activation of nitric oxide synthase by garlic: A basis for its therapeutic applications. Current Medical Research and Opinion 13(5):257–263
53. Fallon MB, Abrams GA, Abdel-Razek TT, Dai J, Chen S-J, Chen Y-F, Luo B, Oparil, Suzanne and Ku, David D. (1998) Garlic prevents hypoxic pulmonary hypertension in rats. The American Physiological Society 275:283–287
54. Kim-Park S, Ku DD (2000) Garlic Elicits A Nitric Oxide-Dependent Relaxation And Inhibits Hypoxic Pulmonary Vasoconstriction In Rats. Clin Exp Pharmacol Physiol 27(10):780–786. doi:10.1046/j.1440-1681.2000.03333.x
55. Lawson LD, Ransom DK, Hughes BG (1992) Inhibition of whole blood platelet-aggregation by compounds in garlic clove extracts and commercial garlic products. Thrombosis Research 65(2):141–156. doi:10.1016/0049-3848(92)90234-2
56. Allison G, Lowe G., Rahman K. (2006) Significance of Garlic and Its Constituents in Cancer and Cardiovascular Disease. Aged Garlic Extract may inhibit aggregation in human platelets by supressing calcium mobilization. JN The Journal of Nutrition. 136:789S–792S
57. Bordia A, Verma SK, Srivastava KC (1998) Effect of garlic (Allium sativum) on blood lipids, blood sugar, fibrinogen and fibrinolytic activity in patients with coronary artery disease. Prostaglandins, Leukotrienes and Essential Fatty Acids 58(4):257–263. doi:10.1016/S0952-3278(98)90034-5
58. Hiyasat B, Sabha D, Grotzinger K, Kempfert J, Rauwald J-W, Mohr F-W, Dhein S (2009) Antiplatelet activity of Allium ursinum and Allium sativum. Pharmacology 83(4):197–204. doi:10.1159/000196811
59. FUKAO H, YOSHIDA H, TAZAWA Y-i, HADA T (2007) Antithrombotic Effects of Odorless Garlic Powder Both in Vitro and in Vivo. Bioscience, Biotechnology, and Biochemistry 71(1):84–90. doi:10.1271/bbb.60380
60. Allison GL, Lowe GM, Rahman K (2012) Aged garlic extract inhibits platelet activation by increasing intracellular cAMP and reducing the interaction of GPIIb/IIIa receptor with fibrinogen. Life Sciences 91(25-26):1275–1280. doi:10.1016/j.lfs.2012.09.019
61. Teranishi K, Apitz-Castro R, Robson SC, Romano E, Cooper DKC (2003) Inhibition of baboon platelet aggregation in vitro and in vivo by the garlic derivative, ajoene. Xenotransplantation 10(4):374–379. doi:10.1034/j.1399-3089.2003.02068.x
62. Bordia T, Mohammed N, Thomson M, Ali M (1996) An evaluation of garlic and onion as antithrombotic agents. Prostaglandins, Leukotrienes and Essential Fatty Acids 54(3):183–186. doi:10.1016/S0952-3278(96)90014-9
63. Siegers C-P, Röbke A, Pentz R (1999) Effects of garlic preparations on superoxide production by phorbol ester activated granulocytes. Phytomedicine 6(1):13–16. doi:10.1016/S0944-7113(99)80029-4
64. Popov I, Blumstein A, Lewin G (1994) Antioxidant effects of aqueous garlic extract. 1st communication: Direct detection using the photochemiluminescence. Arzneimittelforschung 44(5):602–604
65. Imai J, Ide N, Nagae S, Moriguchi T, Matsuura H, Itakura Y (1994) Antioxidant and radical scavenging effects of aged garlic extract and its constituents. Planta Med 60(5):417–420. doi:10.1055/s-2006-959522
66. Hiramatsu K, Tsuneyoshi T, Ogawa T, Morihara N (2016) Aged garlic extract enhances heme oxygenase-1 and glutamate-cysteine ligase modifier subunit expression via the nuclear factor erythroid 2-related factor 2-antioxidant response element signaling pathway in human endothelial cells. Nutr Res 36(2):143–149. doi:10.1016/j.nutres.2015.09.018
67. Lamm DL, Riggs DR (2000) THE POTENTIAL APPLICATION OF ALLIUM SATIVUM (GARLIC) FOR THE TREATMENT OF BLADDER CANCER. Urologic Clinics of North America 27(1):157–162. doi:10.1016/S0094-0143(05)70243-3
68. Tsubura A, Lai Y-C, Kuwata M, Uehara N, Yoshizawa K (2011) Anticancer Effects of Garlic and Garlic-derived Compounds for Breast Cancer Control. ACAMC 11(3):249–253. doi:10.2174/187152011795347441
69. Obioha UE, Suru SM, Ola-Mudathir KF, Faremi TY (2009) Hepatoprotective potentials of onion and garlic extracts on cadmium-induced oxidative damage in rats. Biol Trace Elem Res 129(1-3):143–156. doi:10.1007/s12011-008-8276-7
70. Kabasakal L, Sehirli O, Cetinel S, Cikler E, Gedik N, Sener G (2005) Protective effect of aqueous garlic extract against renal ischemia/reperfusion injury in rats. J Med Food 8(3):319–326. doi:10.1089/jmf.2005.8.319
71. Prasad, Mantha, Kalra, Lee (1997) Prevention of Hypercholesterolemic Atherosclerosis by Garlic, an Antixoidant. J Cardiovasc Pharmacol Ther 2(4):309–320. doi:10.1177/107424849700200409
72. Brunetti L, Menghini L, Orlando G, Recinella L, Leone S, Epifano F, Lazzarin F, Chiavaroli A, Ferrante C, Vacca M (2009) Antioxidant effects of garlic in young and aged rat brain in vi
tro. J Med Food 12(5):1166–1169. doi:10.1089/jmf.2008.0176
73. Wei, Zhihua and Lau, Benjamin H.S. (1998) Garlic inhibits free radical generation and augments antioxidant enzyme activity in vascular endothelial cells. Nutrition Research 18(1):61–70
74. Farbman KS, Barnett ED, Bolduc, G. R. and Klein, J. O. (1993) Antibacterial activity of garlic and onions: a historical perspective. The Pediatric Infectious Disease Journal 12(7):613–614
75. Casella S, Leonardi M, Melai B, Fratini F, Pistelli L (2013) The role of diallyl sulfides and dipropyl sulfides in the in vitro antimicrobial activity of the essential oil of garlic, Allium sativum L., and leek, Allium porrum L. Phytother Res 27(3):380–383. doi:10.1002/ptr.4725
76. Kyung KH (2012) Antimicrobial properties of allium species. Curr Opin Biotechnol 23(2):142–147. doi:10.1016/j.copbio.2011.08.004
77. Li W-R, Shi Q-S, Dai H-Q, Liang Q, Xie X-B, Huang X-M, Zhao G-Z, Zhang L-X (2016) Antifungal activity, kinetics and molecular mechanism of action of garlic oil against Candida albicans. Sci Rep 6:22805. doi:10.1038/srep22805
78. Saha S, Saha SK, Hossain MA, Paul SK, Gomes RR, Imtiaz M, Islam MM, Nahar H, Begum SA, Mirza TT (2016) Anti-Bacterial effect of Aqueous Garlic Extract (AGE) determined by Disc Diffusion Method against Escherichia coli. Mymensingh Med J 25 (1):23–26
79. Yadav S, Trivedi NA, Bhatt JD (2015) Antimicrobial activity of fresh garlic juice. An in vitro study. Ayu 36(2):203–207. doi:10.4103/0974-8520.175548
80. Durairaj S, Srinivasan, S. and Lakshmanaperumalsamy, P. (2009) In vitro Antibacterial Activity and Stability of Garlic Extract at Different pH and Temperature. Electronic Journal of Biology 5(1):5–10
81. Davis SR, Perrie, R. and Apitz-Castro, R. (2003) The in vitro susceptibility of Scedosporium prolificans to ajoene, allitridium and a raw extract of garlic (Allium sativum). Journal of Antimicrobial Chemotherapy 51(3):593–597. doi:10.1093/jac/dkg144
82. Watzl B (2002) Sulfide. Ernährungs-Umschau 49(12):493–496
83. Harris J, S. C, S. P, D. L (2001) Antimicrobial properties of Allium sativum (garlic). Applied Microbiology and Biotechnology 57(3):282–286. doi:10.1007/s002530100722
84. Benkeblia N (2004) Antimicrobial activity of essential oil extracts of various onions (Allium cepa) and garlic (Allium sativum). LWT – Food Science and Technology 37(2):263–268. doi:10.1016/j.lwt.2003.09.001
85. Weber ND, Andersen DO, North JA, Murray BK, Lawson LD, Hughes BG (1992) In vitro virucidal effects of Allium sativum (garlic) extract and compounds. Planta Med 58(5):417–423. doi:10.1055/s-2006-961504
86. Madkor HR, Mansour SW, Ramadan G (2011) Modulatory effects of garlic, ginger, turmeric and their mixture on hyperglycaemia, dyslipidaemia and oxidative stress in streptozotocin-nicotinamide diabetic rats. Br J Nutr 105(8):1210–1217. doi:10.1017/S0007114510004927
87. Thomson M, Al-Qattan KK, J S D, Ali M (2016) Anti-diabetic and anti-oxidant potential of aged garlic extract (AGE) in streptozotocin-induced diabetic rats. BMC Complement Altern Med 16:17. doi:10.1186/s12906-016-0992-5
88. Sarkaki A, Valipour Chehardacheric S, Farbood Y, Mansouri SMT, Naghizadeh B, Basirian E (2013) Effects of fresh, aged and cooked garlic extracts on short- and long-term memory in diabetic rats. Avicenna J Phytomed 3(1):45–55
89. Swanston-Flatt SK, Day C, Bailey CJ, Flatt PR (1990) Traditional plant treatments for diabetes. Studies in normal and streptozotocin diabetic mice. Diabetologia 33(8):462–464. doi:10.1007/BF00405106
90. Shiju TM, Rajesh NG, Viswanathan P (2013) Renoprotective effect of aged garlic extract in streptozotocin-induced diabetic rats. Indian J Pharmacol 45(1):18–23. doi:10.4103/0253-7613.106429
91. Nillert N, Pannangrong W, Welbat JU, Chaijaroonkhanarak W, Sripanidkulchai K, Sripanidkulchai B (2017) Neuroprotective Effects of Aged Garlic Extract on Cognitive Dysfunction and Neuroinflammation Induced by β-Amyloid in Rats. Nutrients 9(1). doi:10.3390/nu9010024
92. Hermawati E, Sari DCR, Partadiredja G (2015) The effects of black garlic ethanol extract on the spatial memory and estimated total number of pyramidal cells of the hippocampus of monosodium glutamate-exposed adolescent male Wistar rats. Anat Sci Int 90(4):275–286. doi:10.1007/s12565-014-0262-x
93. Pérez-Severiano F, Rodríguez-Pérez M, Pedraza-Chaverrí J, Maldonado PD, Medina-Campos ON, Ortíz-Plata A, Sánchez-García A, Villeda-Hernández J, Galván-Arzate S, Aguilera P, Santamaría A (2004) S-Allylcysteine, a garlic-derived antioxidant, ameliorates quinolinic acid-induced neurotoxicity and oxidative damage in rats. Neurochem Int 45(8):1175–1183. doi:10.1016/j.neuint.2004.06.008
94. Rojas P, Serrano-García N, Medina-Campos ON, Pedraza-Chaverri J, Maldonado PD, Ruiz-Sánchez E (2011) S-Allylcysteine, a garlic compound, protects against oxidative stress in 1-methyl-4-phenylpyridinium-induced parkinsonism in mice. J Nutr Biochem 22(10):937–944. doi:10.1016/j.jnutbio.2010.08.005
95. Colín-González AL, Ortiz-Plata A, Villeda-Hernández J, Barrera D, Molina-Jijón E, Pedraza-Chaverrí J, Maldonado PD (2011) Aged garlic extract attenuates cerebral damage and cyclooxygenase-2 induction after ischemia and reperfusion in rats. Plant Foods Hum Nutr 66(4):348–354. doi:10.1007/s11130-011-0251-3
96. Warshafsky S (1993) Effect of Garlic on Total Serum Cholesterol. Ann Intern Med 119(7_Part_1):599. doi:10.7326/0003-4819-119-7_Part_1-199310010-00009
97. Reinhart KM, Talati R, White CM, Coleman CI (2009) The impact of garlic on lipid parameters. A systematic review and meta-analysis. Nutr Res Rev 22(1):39–48. doi:10.1017/S0954422409350003
98. Stevinson C, Pittler, Max H. and Ernst, Edzard (2000) Garlic for Treating Hypercholesterolemia. Ann Intern Med 133(6):420. doi:10.7326/0003-4819-133-6-200009190-00009
99. Zeng T, Guo F-F, Zhang C-L, Song F-Y, Zhao X-L, Xie K-Q (2012) A meta-analysis of randomized, double-blind, placebo-controlled trials for the effects of garlic on serum lipid profiles. J Sci Food Agric 92(9):1892–1902. doi:10.1002/jsfa.5557
100. Alder R, Lookinland S, Berry JA, Williams M (2003) A Systematic Review of the Effectiveness of Garlic as an Anti-Hyperlipidemic Agent. J Amer Acad Nurse Practitioners 15(3):120–129. doi:10.1111/j.1745-7599.2003.tb00268.x
101. Ried K (2016) Garlic Lowers Blood Pressure in Hypertensive Individuals, Regulates Serum Cholesterol, and Stimulates Immunity. An Updated Meta-analysis and Review. J Nutr 146(2):389S–396S. doi:10.3945/jn.114.202192
102. Xiong XJ, Wang PQ, Li SJ, Li XK, Zhang YQ, Wang J (2015) Garlic for hypertension. A systematic review and meta-analysis of randomized controlled trials. Phytomedicine 22(3):352–361. doi:10.1016/j.phymed.2014.12.013
103. Wang H-P, Yang J, Qin L-Q, Yang X-J (2015) Effect of garlic on blood pressure. A meta-analysis. J Clin Hypertens (Greenwich) 17(3):223–231. doi:10.1111/jch.12473
104. Rohner A, Ried K, Sobenin IA, Bucher HC, Nordmann AJ (2015) A systematic review and metaanalysis on the effects of garlic preparations on blood pressure in individuals with hypertension. Am J Hypertens 28(3):414–423. doi:10.1093/ajh/hpu165
105. Steiner, M. and Li, W. (2001) Aged Garlic Extract, a Modulator of Cardiovascular Aged Garlic Extract, a Modulator of Cardiovascular Risk Factors: A Dose-Finding Study on the Effects of AGE on Platelet Functions. J Nutr 131:980–984
106. Kiesewetter H, Jung F, Jung EM, Mrowietz C, Koscielny J, Wenzel E (1993) Effect of garlic on platelet aggregation in patients with increased risk of juvenile ischaemic attack. Eur J Clin Pharmacol 45(4). doi:10.1007/BF00265950
107. Kiesewetter H, Jung F, Jung EM, Blume J, Mrowietz C, Birk A, Koscielny J, Wenzel E (1993) Effects of garlic coated tablets in peripheral arterial occlusive disease. Clin Investig 71(5). doi:10.1007/BF00186628
108. Rahman, Khalid and Billington, David (2000) Dietary Supplementation with Aged Garlic Extract Inhibits ADP-Induced Platelet Aggregation in Humans. J Nutr 130:2662–2665
109. Lissiman E, Bhasale AL, Cohen M (2014) Garlic for the common cold. Cochrane Database Syst Rev (11):CD006206. doi:10.1002/14651858.CD006206.pub4
110. Josling P (2001) Preventing the common cold with a garlic supplement: A double-blind, placebo-controlled survey. Advances In Natural Therapy™ 18(4):189–193
111. Nantz MP, Rowe CA, Muller CE, Creasy RA, Stanilka JM, Percival SS (2012) Supplementation with aged garlic extract improves both NK and γδ-T cell function and reduces the severity of cold and flu symptoms. A randomized, double-blind, placebo-controlled nutrition intervention. Clin Nutr 31(3):337–344. doi:10.1016/j.clnu.2011.11.019
112. Phil RAM, Khan, Rafeeq Alam and Ashraf, Imran (2011) Effects of garlic on blood glucose levels and HbA1c in patients with type 2 diabetes mellitus. Journal of Medicinal Plants Research 5(13):2922–2928
113. Sobenin IA, Nedosugova LV, Filatova LV, Balabolkin MI, Gorchakova TV, Orekhov AN (2008) Metabolic effects of time-released garlic powder tablets in type 2 diabetes mellitus. The results of double-blinded placebo-controlled study. Acta Diabetol 45(1):1–6. doi:10.1007/s00592-007-0011-x
114. Europäisches Arzneibuch – Pharmacopoeia Europaea. Tang – Fucus vel Ascophyllum. 8. Ausgabe, Grundwerk 2014
115. König R, Winkler G (Hrsg) (2007) C. Plinius Secundus d. Ä, Naturheilkunde. Botanik: Bäume, 2. Aufl. Sammlung Tusculum, lateinisch – deutsch / C. Plinius Secundus d. Ä. Hrsg. und übers. von Roderich König in Zusammenarb. mit Joachim Hopp und Wolfgang Glöckner ; Bücher 12/13. Artemis & Winkler, München
116. Wikström JE (Hrsg) Jahresbericht der Königl. Schwedischen Akademie der Wissenschaften über die fortschritte der Botanik in den letzten Jahren vor und bis 1820, und in den Jahren 1821[-1842]. Original von University of Chicago. In commission bei J. Max & comp., 1834, Breslau
117. Caroli Linnaei (Hrsg) (1753) Species plantarum, exhibentes plantas rite cognitas, ad genera relatas, cum differentiis specificis, nominibus trivialibus, synonymis selectis, locis natalibus, secundum systema sexuale digestas. Holmiae, Impensis Laurentii Salvii. (Digitalisierte Fassung unter: http://www.botanicus.org/page/358012). Band 1
118. Hänsel R, Keller K, Rimpler H, Schneider G. U., Wurm G, Aye RD et al (Hrsg) (1993) Hagers Handbuch der Pharmazeutischen Praxis. Drogen E-O, 5. Aufl. Springer Berlin Heidelberg, Berlin, Heidelberg, s.l.
119. Seyb HG (Hrsg) (1956) Botanik und Drogenkunde. Vieweg+Teubner Verlag, Wiesbaden
120. European Medicines Agency, Committee on Herbal Medicinal Products (2013) Assessment report on Fucus vesiculosus L., thallus. EMA/HMPC/313675/2012
121. Delfosse M. (Hrsg) (1998) Drogues végétales et plantes médicinales. APB – Service scientifique
122. Williamson E, Driver, S. and Baxter, K. (Hrsg) (2009) Stockley’s herbal medicines interactions. Pharmaceutical Press, London
123. Van Hellemont J. (Hrsg) (1985) Fytotherapeutisch Compendium. Algemene Pharmaceutische Bond, Brussel
124. Bradley PR (Hrsg) (1992) British herbal compendium. A handbook of scientific information on widely used plant drugs. Volume 1. British Herbal Medicine Association, Dorset
125. Verhelst G (Hrsg) (2010) Groot handboek geneeskrachtige planten, 4. Aufl. BVBA Mannavita, Wevelgem, België
126. De Smet, Peter A. G. M., Keller K, Hänsel R, Chandler RF (Hrsg) (1997) Adverse Effects of Herbal Drugs, 3. Aufl. Adverse Effects of Herbal Drugs. Springer Berlin Heidelberg, Berlin, Heidelberg
127. Barnes J, Anderson LA, Phillipson JD (Hrsg) (2007) Herbal Medicines, 3. Aufl. Pharmaceutical Press, London and Chicago
128. Morel J-M, Perrey F, Lejeune R, Goetz P (2005) Fucus vesiculosus L. Phytothérapie 3(5):218–221. doi:10.1007/s10298-005-0108-8
129. European Medicines Agency, Committee on Herbal Medicinal Products (2013) Community herbal monograph on Fucus vesiculosus L., thallus. EMA/HMPC/313674/2012
130. British Herbal Medicine Association (Hrsg) British herbal pharmacopoeia 1983. Consolidated edition, Bournemouth, United Kingdom
131. EFSA (2006) Tolerable upper intake levels for vitamins and minerals. European Food Safety Authority, Parma
132. Scientific Committee on Food (2002) Opinion of the Scientific Committee on Food on the Tolerable Upper Intake Level of Iodine. European Commission Health & Consumer Protection Directorate
133. Eliason BC (1998) Transient Hyperthyroidism in a Patient Taking Dietary Supplements Containing Kelp. The Journal of the American Board of Family Medicine 11(6):478–480. doi:10.3122/jabfm.11.6.478
134. Shilo S, Hirsch HJ (1986) Iodine-induced hyperthyroidism in a patient with a normal thyroid gland. Postgraduate Medical Journal 62(729):661–662. doi:10.1136/pgmj.62.729.661
135. De Smet, Peter A. G. M., Stricker BH, Wilderink F, Wiersinga WM (1990) Hyperthyroidism during treatment with kelp tablets. Ned Tijdschr Geneeskd 134(21):1058–1059
136. Hartman AA (1990) Hyperthyroidism during administration of kelp tablets. Ned Tijdschr Geneeskd 134(28):1373
137. Ishizuki Y, Yamauchi K, Miura Y (1989) Transient Thyrotoxicosis Induced by Japanese Kombu. Nihon Naibunpi Gakkai Zasshi 65(2):91–98
138. Di Matola T, Zeppa P, Gasperi M, Vitale M (2014) Thyroid dysfunction following a kelp-containing marketed diet. BMJ Case Rep 2014. doi:10.1136/bcr-2014-206330
139. Arum SM, He X, Braverman LE (2009) Excess iodine from an unexpected source. N Engl J Med 360(4):424–426. doi:10.1056/NEJMc0807580
140. Luyckx VA, Naicker S (2008) Acute kidney injury associated with the use of traditional medicines. Nat Clin Pract Nephrol 4(12):664–671. doi:10.1038/ncpneph0970
141. Pye KG, Kelsey SM, House IM, Newland AC (1992) Severe dyserythropoiesis and autoimmune thrombocytopenia associated with ingestion of kelp supplements. The Lancet 339:1540
142. Amster E, Tiwary A, Schenker MB (2007) Case report. Potential arsenic toxicosis secondary to herbal kelp supplement. Environ Health Perspect 115(4):606–608. doi:10.1289/ehp.9495
143. Walkiw O, Douglas DE (1975) Health Food Supplements Prepared from Kelp. A Source of Elevated Urinary Arsenic. Clinical Toxicology 8(3):325–331
144. Skibola CF (2004) The effect of Fucus vesiculosus, an edible brown seaweed, upon menstrual cycle length and hormonal status in three pre-menopausal women. A case report. BMC Complement Altern Med 4:10. doi:10.1186/1472-6882-4-10
145. Yarnell E, Abascal K (2006) Botanical medicine for thyroid regulation. Alternative and Complementary Therapies 12(3):107–112
146. De Smet PAGM, Keller K, Hänsel R, Chandler RF (Hrsg) (1993) Adverse Effects of Herbal Drugs, 2. Aufl. Springer Verlag, Berlin, Heidelberg
147. Arbaizar B, Llorca J (2011) Fucus vesiculosus induced hyperthyroidism in a patient undergoing concomitant treatment with lithium. Actas Esp Psiquiatr 39(6):401–403
148. Ferreira PG, Costa S, Dias N, Ferreira AJ, Franco F (2014) Simultaneous interstitial pneumonitis and cardiomyopathy induced by venlafaxine. J. bras. pneumol. 40(3):313–318. doi:10.1590/S1806-37132014000300015
149. Zaragozá MC, López D, P Sáiz M, Poquet M, Pérez J, Puig-Parellada P, Màrmol F, Simonetti P, Gardana C, Lerat Y, Burtin P, Inisan C, Rousseau I, Besnard M, Mitjavila MT (2008) Toxicity and antioxidant activity in vitro and in vivo of two Fucus vesiculosus extracts. J Agric Food Chem 56(17):7773–7780. doi:10.1021/jf8007053
150. Shan X, Liu X, Hao J, Cai C, Fan F, Dun Y, Zhao X, Liu X, Li C, Yu G (2016) In vitro and in vivo hypoglycemic effects of brown algal fucoidans. Int J Biol Macromol 82:249–255. doi:10.1016/j.ijbiomac.2015.11.036
151. Leite-Silva C, Gusmão CLS, Takahashi CS (2007) Genotoxic and antigenotoxic effects of Fucus vesiculosus extract on cultured human lymphocytes using the chromosome aberration and Comet assays. Genet. Mol. Biol. 30(1):105–111. doi:10.1590/S1415-47572007000100019
152. Roy M-C, Anguenot R, Fillion C, Beaulieu M, Bérubé J, Richard D (2011) Effect of a commercially-available algal phlorotannins extract on digestive enzymes and carbohydrate absorption in vivo. Food Research International 44(9):3026–3029. doi:10.1016/j.foodres.2011.07.023
153. Liu B, Kongstad KT, Wiese S, Jäger AK, Staerk D (2016) Edible seaweed as future functional food. Identification of α-glucosidase inhibitors by combined use of high-resolution α-glucosidase inhibition profiling and HPLC-HRMS-SPE-NMR. Food Chem 203:16–22. doi:10.1016/j.foodchem.2016.02.001
154. Dürig J, Bruhn T, Zurborn KH, Gutensohn K, Bruhn HD and Beress L (1997) Anticoagulant fucoidan fractions from Fucus vesiculosus induce platelet activation in vitro. Thrombosis Research 85(6):479–491
155. Trento F, Cattaneo F, Pescador R, Porta R, Ferro L (2001) Antithrombin Activity of an Algal Polysaccharide. Thrombosis Research 102(5):457–465. doi:10.1016/S0049-3848(01)00264-X
156. Kwak K-W, Cho K-S, Hahn O-J, Lee K-H, Lee B-Y, Ko J-J, Chung K-H (2010) Biological effects of fucoidan isolated from Fucus vesiculosus on thrombosis and vascular cells. Korean J Hematol 45(1):51–57. doi:10.5045/kjh.2010.45.1.51
157. de Azevedo, Tarciana Carvalho G., Bezerra MEB, Santos MdGdL, Souza LA, Marques CT, Benevides NMB, Leite EL (2009) Heparinoids algal and their anticoagulant, hemorrhagic activities and platelet aggregation. Biomed Pharmacother 63(7):477–483. doi:10.1016/j.biopha.2008.09.012
158. Cumashi A, Ushakova NA, Preobrazhenskaya ME, D’Incecco A, Piccoli A, Totani L, Tinari N, Morozevich GE, Berman AE, Bilan MI, Usov AI, Ustyuzhanina NE, Grachev AA, Sanderson CJ, Kelly M, Rabinovich GA, Iacobelli S, Nifantiev NE (2007) A comparative study of the anti-inflammatory, anticoagulant, antiangiogenic, and antiadhesive activities of nine different fucoidans from brown seaweeds. Glycobiology 17(5):541–552. doi:10.1093/glycob/cwm014
159. Liu H, Gu L (2012) Phlorotannins from brown algae (Fucus vesiculosus) inhibited the formation of advanced glycation endproducts by scavenging reactive carbonyls. J Agric Food Chem 60(5):1326–1334. doi:10.1021/jf204112f
160. Thring TSA, Hili, Pauline and Naughton, Declan P. (2009) Anti-collagenase, anti-elastase and anti-oxidant activities of extracts from 21 plants. BMC Complement Altern Med 9:1–11. doi:10.1186/1472-6882-9-27
161. Fujimura T, Shibuya Y, Moriwaki S, Tsukahar K, Kitahara T, Sano T, Nishizawa Y and Takema Y (2000) Fucoidan is the active component of Fucus vesiculosus that promotes contraction of fibroblast-populated collagen gels. Biological and Pharmaceutical Bulletin 23(10):1180–1184
162. Skibola CF, Curry JD, VandeVoort C, Conley A and Smith MT (2005) Brown kelp modulates endocrine hormones in female Sprague-Dawley rats and in human luteinized granulosa cells. J Nutr 135(2):296–300
163. Parys S, Kehraus S, Krick A, Glombitza K-W, Carmeli S, Klimo K, Gerhäuser C, König GM (2010) In vitro chemopreventive potential of fucophlorethols from the brown alga Fucus vesiculosus L. by anti-oxidant activity and inhibition of selected cytochrome P450 enzymes. Phytochemistry 71(2-3):221–229. doi:10.1016/j.phytochem.2009.10.020
164. Oomizu S, Yanase Y, Suzuki H, Kameyoshi Y, Hide M (2006) Fucoidan prevents C epsilon germline transcription and NFkappaB p52 translocation for IgE production in B cells. Biochem Biophys Res Commun 350(3):501–507. doi:10.1016/j.bbrc.2006.08.009
165. Price JA, Sanny C, Shevlin D (2002) Inhibition of mast cells by algae. J Med Food 5(4):205–210. doi:10.1089/109662002763003357
166. Choi E-M, Kim A-J, Kim Y-O, Hwang J-K (2005) Immunomodulating activity of arabinogalactan and fucoidan in vitro. J Med Food 8(4):446–453. doi:10.1089/jmf.2005.8.446
167. Kim M-H, Joo H-G (2008) Immunostimulatory effects of fucoidan on bone marrow-derived dendritic cells. Immunol Lett 115(2):138–143. doi:10.1016/j.imlet.2007.10.016
168. Byon YY, Kim MH, Yoo ES, Hwang KK, Jee, Y, Shin T, Joo HG (2008) Radioprotective effects of fucoidan on bone marrow cells: improvement of the cell survival and immunoreactivity. Journal of Veterinary Science 9(4):359–365
169. Rupérez P, Ahrazem O, Leal JA (2002) Potential Antioxidant Capacity of Sulfated Polysaccharides from the Edible Marine Brown Seaweed Fucus vesiculosus. J. Agric. Food Chem. 50(4):840–845. doi:10.1021/jf010908o
170. O’Sullivan AM, O’Callaghan YC, O’Grady MN, Queguineur B, Hanniffy D, Troy DJ, Kerry JP, O’Brien NM (2011) In vitro and cellular antioxidant activities of seaweed extracts prepared from five brown seaweeds harvested in spring from the west coast of Ireland. Food Chem 126(3):1064–1070. doi:10.1016/j.foodchem.2010.11.127
171. Díaz-Rubio ME, Pérez-Jiménez J, Saura-Calixto F (2009) Dietary fiber and antioxidant capacity in Fucus vesiculosus products. Int J Food Sci Nutr 60 Suppl 2:23–34. doi:10.1080/09637480802189643
172. Rhee KH, Lee KH (2011) Protective effects of fucoidan against γ-radiation-induced damage of blood cells. Arch Pharm Res 34(4):645–651. doi:10.1007/s12272-011-0415-6
173. Angulo Y, Lomonte B (2003) Inhibitory effect of fucoidan on the activities of crotaline snake venom myotoxic phospholipases A2. Biochemical Pharmacology 66(10):1993–2000. doi:10.1016/S0006-2952(03)00579-3
174. Queiroz KCS, Medeiros VP, Queiroz LS, Abreu LRD, Rocha HAO, Ferreira CV, Jucá MB, Aoyama H, Leite EL (2008) Inhibition of reverse transcriptase activity of HIV by polysaccharides of brown algae. Biomed Pharmacother 62(5):303–307. doi:10.1016/j.biopha.2008.03.006
175. Ritter LS, Copeland JG, McDonagh PF (1998) Fucoidin reduces coronary microvascular leukocyte accumulation early in reperfusion. The Annals of Thoracic Surgery 66(6):2063–2071. doi:10.1016/S0003-4975(98)00823-6
176. Aisa Y, Miyakawa Y, Nakazato T, Shibata H, Saito K, Ikeda Y, Kizaki M (2005) Fucoidan induces apoptosis of human HS-sultan cells accompanied by activation of caspase-3 and down-regulation of ERK pathways. Am J Hematol 78(1):7–14. doi:10.1002/ajh.20182
177. Hyun J-H, Kim S-C, Kang J-I, Kim M-K, Boo H-J, Kwon J-M, Koh Y-S, Hyun J-W, Park D-B, Yoo E-S, Kang H-K (2009) Apoptosis Inducing Activity of Fucoidan in HCT-15 Colon Carcinoma Cells. Biological & Pharmaceutical Bulletin 32(10):1760–1764. doi:10.1248/bpb.32.1760
178. Ale MT, Maruyama H, Tamauchi H, Mikkelsen JD, Meyer AS (2011) Fucose-containing sulfated polysaccharides from brown seaweeds inhibit proliferation of melanoma cells and induce apoptosis by activation of caspase-3 in vitro. Mar Drugs 9(12):2605–2621. doi:10.3390/md9122605
179. Lamela M, Anca J, Villar R, Otero J, Calleja JM (1989) Hypoglycaemic activity of several seaweed extracts. J Ethnopharmacol 27(1-2):35–43
180. Ale MT, Maruyama H, Tamauchi H, Mikkelsen JD, Meyer AS (2011) Fucoidan from Sargassum sp. and Fucus vesiculosus reduces cell viability of lung carcinoma and melanoma cells in vitro and activates natural killer cells in mice in vivo. Int J Biol Macromol 49(3):331–336. doi:10.1016/j.ijbiomac.2011.05.009
181. Veena CK, Josephine A, Preetha SP, Varalakshmi P (2007) Beneficial role of sulfated polysaccharides from edible seaweed Fucus vesiculosus in experimental hyperoxaluria. Food Chem 100(4):1552–1559. doi:10.1016/j.foodchem.2005.12.040
182. Aksenov DV, Kaplun VV, Tertov VV, Sobenin IA, Orekhov AN (2007) Effect of plant extracts on trans-sialidase activity in human blood plasma. Bull Exp Biol Med 143(1):46–50. doi:10.1007/s10517-007-0013-2
183. Fujimura T, Tsukahara K, Moriwaki S, Kitahara T, Sano T, Takema Y (2002) Treatment of human skin with an extract of Fucus vesiculosus changes its thickness and mechanical properties. Journal of Cosmetic Science 53:1–9
184. Abidov M, Ramazanov Z, Seifulla R, Grachev S (2010) The effects of Xanthigen in the weight management of obese premenopausal women with non-alcoholic fatty liver disease and normal liver fat. Diabetes Obes Metab 12(1):72–81. doi:10.1111/j.1463-1326.2009.01132.x
185. Myers SP, O’Connor J, Fitton JH, Brooks L, Rolfe M, Connellan P, Wohlmuth H, Cheras P A, Morris C. (2010) A combined phase I and II open label study on the effects of a seaweed extract nutrient complex on osteoarthritis. Biologics: Targets & Therapy (BTT) 4:33–44. doi:10.2147/BTT.S8354
186. Hänsel R, Keller K, Rimpler H et al (Hrsg) (1992) Drogen A-D, 5. Aufl. Springer Berlin Heidelberg, Berlin, Heidelberg, s.l.
187. WHO monographs on selected medicinal plants. Volume 2. Folium cum Flore Crataegi. World Health Organisation: Geneva; 2002
188. Europäisches Arzneibuch – Pharmacopoeia Europaea. Weißdornblätter mit Blüten – Crataegi folium cum flore. 8. Ausgabe, Grundwerk 2014
189. Mordecai Cubitt Cooke, John Eller Taylor (Hrsg) (1876) Hardwicke’s Science-gossip: An Illustrated Medium of Interchange and Gossip for Students and Lovers of Nature, Bände 12-13. Robert Hardwicke
190. Schantz P (Hrsg) (2009) Weißdorn und Herzgespann. Medizinhistorische Untersuchungen zur europäischen Tradition dieser Arzneipflanzen vom Mittelalter bis zur Gegenwart. Studien des Aachener Kompetenzzentrums für Wissenschaftsgeschichte, Bd 6. Kassel Univ. Press, Kassel
191. Hegi G (1975) Illustrierte Flora von Mitteleuropa, Bd. IV 2b, JF Lehmanns-Verlag. München. S.725-739
192. Christensen KI (1992) Revision of Crataegus Sect. Crataegus and Nothosect. Crataeguineae (Rosaceae-Maloideae) in the Old World – In: Systematic Botany Monographs, Vol. 35— In: Anderson C, Systematic Botany Monographs, vol. 35, American Society of Plant Taxonomists: 1:1–199
193. European Medicines Agency, Committee on Herbal Medicinal Products Assessment report on Crataegus spp., folium cum flore. EMA/HMPC/159076/2014
194. Blaschek W, Hilgenfeldt U, Holzgrabe U, Reichling J, Ruth P, Schulz V. (Hrsg) (2011) HagerROM 2011. Hagers Enzyklopädie der Arzneistoffe und Drogen. Version 10.3. Springer Medizin Verlag, Heidelberg
195. Edwards JE, Brown PN, Talent N, Dickinson TA, Shipley PR (2012) A review of the chemistry of the genus Crataegus. Phytochemistry 79:5–26. doi:10.1016/j.phytochem.2012.04.006
196. Steinegger E, Hänsel R (Hrsg) (1988) Lehrbuch der Pharmakognosie und Phytopharmazie. Vierte, vollständig neubearbeitete Auflage. Springer-Verlag Berlin Heidelberg GmbH
197. ESCOP Monographs – The Scientific Foundation for Herbal Medicinal Products. Crataegi folium cum flore – Hawthorn Leaf and Flower. Second Edition. Thieme Verlag: Stuttgart; 2003
198. Bradley P. (Hrsg) (2006) British Herbal Compendium – A handbook of scientific information on widely used plant drugs. Volume 2. British Herbal Medicine Association, Bournemouth
199. Chang Q, Zuo Z, Harrison F, Chow MSS (2002) Hawthorn. The Journal of Clinical Pharmacology 42(6):605–612. doi:10.1177/00970002042006003
200. Kaul R. (Hrsg) (1998) Der Weißdorn. Botanik, Inhaltsstoffe, Qualitätskontrolle, Pharmakologie, Toxikologie und Klinik. Stuttgart. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart
201. Schulz H (Hrsg) (1919) Vorlesungen über Wirkung und Anwendung der deutschen Arzneipflanzen. Verlag Georg Thieme, Leipzig
202. Ripperger W (Hrsg) (1937) Grundlagen zur praktischen Pflanzenheilkund. Hippokrates-Verlag HmbHerlag Georg Thieme, Stuttgart-Leipzig
203. Madaus G (Hrsg) (1976) Lehrbuch der biologischen Heilmittel. (Nachdruck vom Original 1938). Georg Olms Verlag, Hildesheim
204. Kommission E Monographie – Crataegi folium cum flore (Weißdornblätter mit Blüten). Bundesanzeiger Nr. 133,1994
205. European Medicines Agency, Committee on Herbal Medicinal Products (2014) European Union herbal monograph on Crataegus spp., folium cum flore. EMA/HMPC/159075/2014
206. Daniele C, Mazzanti G, Pittler MH, Ernst E (2006) Adverse-Event Profile of Crataegus Spp. Drug Safety 29(6):523–535. doi:10.2165/00002018-200629060-00005
207. Holubarsch CJF, Colucci WS, Meinertz T, Gaus W, Tendera M (2008) The efficacy and safety of Crataegus extract WS 1442 in patients with heart failure. The SPICE trial. Eur J Heart Fail 10(12):1255–1263. doi:10.1016/j.ejheart.2008.10.004
208. Zick SM, Vautaw BM, Gillespie B, Aaronson KD (2009) Hawthorn Extract Randomized Blinded Chronic Heart Failure (HERB CHF) trial. Eur J Heart Fail 11(10):990–999. doi:10.1093/eurjhf/hfp116
209. Gruenwald J, Brendler T, Jaenicke C (Hrsg) (2007) PDR for herbal medicines., 4. Aufl. Thomson Healthcare Inc., Montvale
210. Tankanow R, Tamer HR, Streetman DS, Smith SG, Welton JL, Annesley T, Aaronson KD, Bleske BE (2003) Interaction Study between Digoxin and a Preparation of Hawthorn (Crataegus oxyacantha ). The Journal of Clinical Pharmacology 43(6):637–642. doi:10.1177/0091270003253417
211. Schlegelmilch R, Heywood R (1994) Toxicity of Crataegus (Hawthorn) Extract (WS 1442). Journal of the American College of Toxicology 13(2):103–111. doi:10.3109/10915819409140991
212. Albrecht A, Juretzek W (Hrsg) (1995) Weißdorn (Cratagus laevigata, Crataegus monogyna), Weißdornblätter mit Blüten (Crataegi folium cum flore). Springer: LoseblattSystem Naturheilverfahren
213. Yao M, Ritchie HE, Brown-Woodman PD (2008) A reproductive screening test of hawthorn. Journal of Ethnopharmacology 118(1):127–132. doi:10.1016/j.jep.2008.03.020
214. Joseph G, Zhao Y, Klaus W (1995) Pharmakologisches Wirkprofil von Crataegus-Extrakt im Vergleich zu Epinephrin, Amrinon, Milrinon und Digoxin am isoliert perfundierten Meerschweinchenherzen. Arzneimittel Forschung/Drug Research 45(12):1261–1265
215. Pöpping S, Fischer Y, Kammermeier H (1994) Crataegus-Wirkung auf Kontraktion und O2-Verbrauch isolierter Herzzellen. Münchener medizinische Wochenschrift 136 (Suppl. 1)(39-46)
216. Gabard B, Trunzler G. Zur Pharmakologie von Crataegus. In: Rietbrock N, Schnieders B, Schuster J, editors. Wandlungen in der Therapie der Herzinsuffizienz. Braunschweig, Friedrich Vieweg und Sohn, 1983: 43-53
217. Brixius K, Frank K, Münch G, Müller-Ehmsen J, Schwinger RHG. (1998) WS 1442 (Crataegus Spezialextrakt) wirkt am insuffizienten menschlichen Myokard Kontraktionskraft-steigernd. Herz Kreislauf 30:28–33
218. Schwinger RHG, Pietsch M, Frank K, Brixius K. (2000) Crataegus special extract WS 1442 increases force of contraction in human myocardium cAMP-independently. Journal of Cardiovascular Pharmcology 35(5):700–707
219. Schmidt-Schweda S, Burstin JV, Möllmann H, Wollner S, Holubarsch C. (2000) Der positiv inotrope Effekt des Cratagus Spezialextrakts WS 1442 in isolierten Myozyten aus menschlichem Vorhof- und Ventrikelmyokard wird vorwiegend durch oligomere Procyanidine vermittelt. Zeitschrift für Kardiologie ; 98 (Suppl):164
220. Dood KP, Frey AD, Geisbuhler TP (2013) The Effect of Hawthorn Extract on Coronary Flow. J Evid Based Complementary Altern Med 18(4):257–267. doi:10.1177/2156587213491428
221. Roddewig C, Hensel H. (1977) Reaktion der lokalen Myokarddurchblutung von wachen Hunden und narkotisierten Katzen auf orale und parenterale Applikation einer Crataegusfraktion (oligomere Procyanidine). Arzneimittel Forschung/Drug Research 27(7):1407–1410
222. Kurcok A. (1992) Ischemia- and reperfusion-induced cardiac injury: effects of two flavonoid containing plant extracts possessing radical scavenging properties. Naunyn-Schmiedeberg’s Arch Pharmacol 345 (Suppl): R81 (Abstr 322)
223. Krzeminski T, Chatterjee SS. (1993) Ischemia and early reperfusion induced arrhythmias: beneficial effects of an extract of Crataegus oxyacantha L. Pharm Pharmacol Lett 3:45–48
224. Chatterjee SS, Koch E, Jaggy H, Krzeminski T (1997) In-vitro- und In-vivo-Untersuchungen zur kardioprotektiven Wirkung von oligomeren Procyanidinen in einem Crataegus-Extrakt aus Blättern mit Blüten. Arzneimittel Forschung/Drug Research 47(7):821–825
225. Al Makdessi S, Sweidan H, Dietz K, Jacob R (1999) Protective effect of Crataegus oxyacantha against reperfusion arrhythmias after global no-flow ischemia in the rat heart. Basic Res Cardiol 94:71–77
226. Veveris M, Koch E, Chatterjee SS (2004) Crataegus special extract WS 1442 improves cardiac function and reduces infarct size in a rat model of prolonged coronary ischemia and reperfusion. Life Sciences 74(15):1945–1955. doi:10.1016/j.lfs.2003.09.050
227. Bleske BE, Zineh I, Hwang HS, Welder GJ, Ghannam MM, Boluyt MO (2007) Evaluation of hawthorn extract on immunomodulatory biomarkers in a pressure overload model of heart failure. Medical Science Monitor: International Medical Journal of experimental and clinical Research 13(12):255–258
228. Jayachandran KS, Khan M, Selvendiran K, Devaraj SN, Kuppusamy P (2010) Crataegus oxycantha extract attenuates apoptotic incidence in myocardial ischemia-reperfusion injury by regulating Akt and HIF-1 signaling pathways. J Cardiovasc Pharmacol 56(5):526–531. doi:10.1097/FJC.0b013e3181f64c51
229. Müller A, Linke W, Zhao Y, Klaus W (1996) Crataegus extract prolongs action potential duration in guinea-pig papillary muscle. Phytomedicine 3(3):257–261. doi:10.1016/S0944-7113(96)80063-8
230. Müller A, Linke W, Klaus W. (1999) Crataegus extract blocks potassium currents in guinea pig ventricular cardiac myocytes. Planta Med 65:335–339
231. Nasa Y, Hashizume H, Ehsanul Hoque AN, Abiko Y (1993) Protective effect of Crataegus extract on the cardiac mechanical dysfunction in isolated perfused working rat heart. Arzneimittel Forschung/Drug Research 43(9):945–949
232. Al Makdessi S, Sweidan H, Müllner S, Jacob R (1996) Myocardial protection by pretreatment with Crataegus oxyacantha. An assessment by means of the release of lactate dehydrogenase by the ischemic and reperfused Langendorff heart. Arzneimittel Forschung/Drug Research 46(1):25–27
233. Fürst R, Zirrgiebel U, Totzke F, Zahler S, Vollmar AM, Koch E (2010) The Crataegus extract WS 1442 inhibits balloon catheter-induced intimal hyperplasia in the rat carotid artery by directly influencing PDGFR-beta. Atherosclerosis 211(2):409–417. doi:10.1016/j.atherosclerosis.2010.04.003
234. Hwang HS, Boluyt MO, Converso K, Russell MW, Bleske BE (2009) Effects of hawthorn on the progression of heart failure in a rat model of aortic constriction. Pharmacotherapy 29(6):639–648. doi:10.1592/phco.29.6.639
235. Brixius K, Willms S, Napp A, Tossios P, Ladage D, Bloch W, Mehlhorn U, Schwinger RHG (2006) Crataegus special extract WS 1442 induces an endothelium-dependent, NO-mediated vasorelaxation via eNOS-phosphorylation at serine 1177. Cardiovasc Drugs Ther 20(3):177–184. doi:10.1007/s10557-006-8723-7
236. Vierling W, Brand N, Gaedcke F, Sensch KH, Schneider E, Scholz M (2003) Investigation of the pharmaceutical and pharmacological equivalence of different Hawthorn extracts*. Phytomedicine 10:8–16
237. Amel B, Seddik K, Shtaywy A, Saliha D, Mussa AZ, Assia B, Abderahmane B, Smain A. (2014) Phytochemical analysis, antioxidant activity and hypotensive effect of algerian azarole (Crataegus azarolus L.) leaves extracts. Research Journal of Pharmaceutical, Biological and Chemical Sciences 5(2):286–305
238. Occhiuto F, Circosta C, Briguglio F, Tommasini A, De Pasquale A (1986) Étude comparée de l’activité cardiovasculaire des jeunes pousses, des feuilles et des fleurs de Crataegus oxyacantha L. I. Activité électrique et tension artérielle chez le rat. Plantes médicinales et Phytothérapie 20:37–51
239. Lièvre M, Andrieu JL, Baconin A (1985) Etude des effets cardiovasculaires de l’hypéroside extrait de l’aubépine chez le chien anesthésié. Ann Pharm Fr 43(5):471–477
240. Fehri B, Aiache JM, Boukef K, Memmi A, Hizaoui B (1991) Valeriana officinalis et Crataegus oxyacantha: Toxicité par administrations réitérées et investigations pharmacologiques. J Pharm Belg 46(3):165–176
241. Rewerski W, Piechocki T, Rylski M, Lewak S (1971) Einige pharmakologische Eigenschaften der aus Weißdorn (Crataegus oxyacantha) isolierten oligomeren Procyanidine. Arzneimittel Forschung/Drug Research 21(6):886–888
242. Shatoor AS, Soliman H, Al-Hashem F, Gamal BE, Othman A, El-Menshawy N (2012) Effect of Hawthorn (Crataegus aronia syn. Azarolus (L)) on platelet function in albino Wistar rats. Thrombosis Research 130(1):75–80. doi:10.1016/j.thromres.2012.01.001
243. Bubik MF, Willer EA, Bihari P, Jürgenliemk G, Ammer H, Krombach F, Zahler S, Vollmar AM, Fürst R (2012) A novel approach to prevent endothelial hyperpermeability. The Crataegus extract WS® 1442 targets the cAMP/Rap1 pathway. J Mol Cell Cardiol 52(1):196–205. doi:10.1016/j.yjmcc.2011.10.020
244. Idris-Khodja N, Auger C, Koch E, Schini-Kerth VB (2012) Crataegus special extract WS(®)1442 prevents aging-related endothelial dysfunction. Phytomedicine 19(8-9):699–706. doi:10.1016/j.phymed.2012.04.005
245. Bahorun T, Trotin F, Pommery J, Vasseur J, Pinkas M (1994) Antioxidant activities of Crataegus monogyna extracts. Planta Med 60:323–328
246. Bahorun T, Gressier B, Trotin F, Brunet C, Dine T, Luyckx M, Vasseur J, Cazin M, Cazin JC, Pinkas M (1996) Oxygen species scavenging activity of phenolic extracts from hawthorn fresh plant organs and pharmaceutical preparations. Arzneimittel Forschung/Drug Research 46:1086–1089
247. Vibes J, Lasserre B, Gleye J, Declume C (1994) Inhibition of thromboxane A2 biosynthesis in vitro by the main components of Crataegus oxyacantha (Hawthorn) flower heads. Prostaglandins Leukotrienes and Essential Fatty Acids 50:173–175
248. Vibes J, Lasserre B, Declume C (1991) Effects of a total extract from Crataegus oxyacantha blossoms an TXA2 and PGI2 biosynthesis in vitro and on TXA2- and PGI2-synthesising activities of cardiac tissue. Med Sci Res 19:143–145
249. Vibes J, Lasserre B, Gleye J (1993) Effects of a methanolic extract from Crataegus oxyacantha blossoms on TXA2 and PGI2 synthesising activities of cardiac tissue. Med Sci Res 21:435–436
250. Schüssler M, Fricke U, Nikolov N, Hölzl J (1991) Comparison of the flavonoids occuring in Crataegus species and inhibition of 3′,5′-cyclic adenosine monophosphate phosphodiesterase. Planta Med 57 (Suppl. 2):A133
251. Petkov E, Nikolov N, Uzunov P (1981) Inhibitory effect of some flavonoids and flavonoid mixtures on cyclic AMP phosphodiesterase activity of rat heart. Planta Med 43:183–186
252. Tauchert M (2002) Efficacy and safety of crataegus extract WS 1442 in comparison with placebo in patients with chronic stable New York Heart Association class-III heart failure. American Heart Journal 143(5):910–915. doi:10.1067/mhj.2002.121463
253. Weikl, A., Assmus, K.-D., Neukum-Schmidt A, Schmitz J, Zapfe G, Noh HS, Siegrist J (1996) Crataegus-Spezialextrakt WS 1442, Objektiver Wirksamkeitsnachweis bei Patienten mit Herzinsuffizienz (NYHA II). Fortschritte der Medizin 114(24):291–296
254. Leuchtgens H (1993) Crategus-Spezialextrakt WS 1442 bei Herzinsuffizienz NYHA II. Eine plazebokontrollierte randomisierte Doppelblindstudie. Fortschritte der Medizin 111(20-21):352–354
255. Zapfe jun G (2001) Clinical efficacy of Crataegus extract WS 1442 in congestive heart failure NYHA class II. Phytomedicine 8(4):262–266. doi:10.1078/0944-7113-00041
256. O’Conolly M, Bernhöft G, Bartsch G (1987) Behandlung älterer, multimorbider Patienten mit stenokardischen Beschwerden. Eine placebokontrollierte Cross-over-Doppelblindstudie mit Crataegutt® novo. Therapiewoche 37:3587–3600
257. Eichstädt H, Bäder M, Danne O, Kaiser W, Stein U, Felix R (1989) Crataegus-Extrakt hilft dem Patienten mit NYHA II-Herzinsuffizienz. Therapiewoche 39:3288–3296
258. Weikl A, Noh HS (1992) Der Einfluß von Crataegus bei globaler Herzinsuffizienz. Herz+Gefäße 12(11):516–524
259. Tauchert M, Gildor A, Lipinski J (1999) Einsatz des hochdosierten Crataegusextraktes WS 1442 in der Therapie der Herzinsuffizienz Stadium NYHA II. Herz 24(6):465–474. doi:10.1007/BF03044432
260. Eggeling T, Regitz-Zagrosek V, Zimmermann A, Burkart M (2011) Baseline severity but not gender modulates quantified Crataegus extract effects in early heart failure–a pooled analysis of clinical trials. Phytomedicine 18(14):1214–1219. doi:10.1016/j.phymed.2011.06.022
261. Schmidt U, Kuhn U, Ploch M, Hübner WD (1994) Efficacy of the Hawthorn (Crataegus) preparation LI 132 in 78 patients with chronic congestive heart failure defined as NYHA functional class II. Phytomedicine 1(1):17–24. doi:10.1016/S0944-7113(11)80018-8
262. Förster A, Förster K, Bühring M, Wolfstädter H (1994) Crataegus bei mäßig reduzierter linksventrikulärer Auswurffraktion. Ergospirometrische Verlaufsuntersuchung bei 72 Patienten in doppelblindem Vergleich mit Plazebo. Münchener medizinische Wochenschrift 136(Suppl. 1):21–26
263. Tauchert M, Ploch M, Hübner WD (1994) Wirksamkeit des Weißdorn-Extraktes LI 132 im Vergleich mit Captopril. Multizentrische Doppelblindstudie bei 132 Patienten mit Herzinsuffizienz im Stadium II nach NYHA. Münchener medizinische Wochenschrift 136(Suppl. 1):27–33
264. Bödigheimer K, Chase D (1994) Wirksamkeit von Weißdorn-Extrakt in der Dosierung 3mal 100 mg täglich. Multizentrische Doppelblindstudie mit 85 herzinsuffizienten Patienten im Stadium NYHA II. Münchener medizinische Wochenschrift 136(Suppl. 1):7–11
Knoblauch ist eine uralte Heilpflanze, die ursprünglich in Zentralasien beheimatet ist, sich aber durch Kultivierung über die ganze Erde ausgebreitet hat. Als Gewürz- und Arzneipflanze wird Knoblauch weltweit vor allem in warmen, gemäßigten Klimazonen, wie dem Mittelmeergebiet, aber auch der USA und Argentinien bis nach Sibirien, China, Indien, Thailand und Südkorea kultiviert. Von Knoblauch gibt es drei Varietäten.
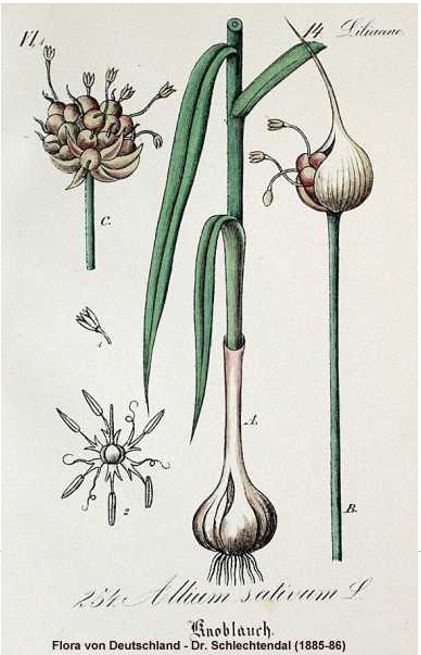
Abbildung 1: Illustration der Botanik von Allium sativum L. angefertigt aus dem Jahre 1885-86
Allium sativum L. ist eine krautige, mehrjährige Pflanze die 25 bis 70 cm hoch wächst. Der aufrechte Stängel ist bis zur Mitte hin mit bis zu 25 mm breiten, linealen, gekielten Laubblättern bestückt. Die Ränder der grasähnlichen Blätter sind glatt oder rau und gegen Ende hin zugespitzt. Der Blütenstand ist doldig, hat wenige Blüten und mehrere Brutzwiebel mit unterschiedlicher Größe und einen Durchmesser von 0,3 bis 1,5 cm. Die Farbe der Blüten kann von rot, hellrosa bis weiß-grün variieren. Die Blüten sitzen an schmalen Blütenstielen, sind selten offen und entwickeln sich oft nicht über das Stadium der Knospe hinaus. Sie bestehen aus Perianthen mit sechs Segmenten, sowie aus sechs Staubblättern und hervorstehenden Staubbeuteln. Die Filamente der inneren Staubblätter sind am Boden verbreitert und die Zipfeln auf beiden Seiten gefächert. Sie besitzen einen oberständigen Fruchtknoten und die Frucht ist eine Spaltkapsel. Samen werden wenn überhaupt sehr selten gebildet und in den Sommermonaten Juli und August ist Blütezeit. Der unterirdische Teil der Pflanze besteht aus der eiförmigen bis kugeligen Knoblauchzwiebel, die sich aus ungefähr 10 bis 20 Haupt- und Neben-Zwiebeln, den sogenannten Zehen, zusammensetzt. Der Durchmesser der einzelnen Knoblauchzehen beträgt 3 bis 5 cm. An der Unterseite des harten, flachen Bodens der Knoblauchzwiebel, dem Zwiebelkuchen, befinden sich viele kleine, kurze, faserige, dünne Wurzeln. Oberhalb des Zwiebelkuchens sitzen die ovalen gekrümmten Hauptzwiebeln, die von dicht aneinander liegenden, kantigen Nebenzwiebeln umschlossen sind. An der äußeren Seite sind die Nebenzwiebeln konvex, an der inneren Seite konkav und nach oben hin verjüngt, wobei sich rund um die Triebknospe ein Niederblatt des Rhizoms umschließt. Alle Zwiebeln sind mit einer weißen und rötlichen papierartigen Membran umschlossen. Weiße, trockenhäutige Niederblatthüllen umschließen die Haupt- und Nebenzwiebeln zusammen [1, 6, 7].
Droge
Als Droge wird die getrocknete und pulverisierte Zwiebel des Knoblauchs verwendet. Das Europäische Arzneibuch fordert einen auf die getrocknete Droge bezogenen Mindestgehalt von 0,45% Allicin. Geerntet wird der Knoblauch mittels Rodemaschinen oder einer breitzahnigen Spatengabel im September oder Oktober, nach dem die Zwiebeln groß genug sind oder die Blätter und der Zwiebelhals vertrocknet sind. Manchmal werden die geernteten Zwiebeln an ihren Laubblättern zusammengebunden. Zur Herstellung des Knoblauchpulvers werden zunächst die Häute der Knoblauchzehen entfernt und die Zehen in ca. 5 mm dicke gleichmäßige Scheiben geschnitten. Getrocknet werden diese anschließend an der Luft oder bei einer Temperatur von maximal 65 °C laut Europäischem Arzneibuch. Im Idealfall, sollte die Temperatur bei der Heißlufttrocknung höchstens 60 °C betragen, um eine bessere Ausbeute zu erzielen. Die Gefriertrocknung dagegen ist eher ungeeignet, da es dabei zu einer raschen Verflüchtigung der in der Knoblauchzwiebel enthaltenen ätherischen Öle kommt. Anschließend werden die getrockneten Scheiben zu Pulver vermahlen. Aus 3 g frischen Knoblauchzwiebel erhält man ca. 1 g an getrocknetem Knoblauch. Das Pulver hat eine hellgelbe bis graue Farbe. Die Weiterverarbeitung erfolgt mit dem standardisierten Knoblauchpulver in Form von Tabletten, Hartgelatinekapseln oder Dragees. Während der Herstellung sollte die Freisetzung des Allicins durch die Allinase Reaktion, sowie mögliche weitere Reaktionen des schon gegenwärtigen Allicins so gut es geht verhindert werden. Der Geruch und Geschmack des Knoblauchs ist stechend scharf bis beißend, aromatisch und hält recht lange an [1, 2, 6, 7].
Bestandteile
Die Bestandteile des Knoblauchs sind sehr komplex und die quantitative Zusammensetzung der Inhaltsstoffe variiert zwischen den verschiedenen Knoblauchpräparaten. Der frische Knoblauch unterscheidet sich im Gehalt der Inhaltsstoffe zum Knoblauchpulver, Knoblauch Trockenextrakt, wässrigen bzw. alkoholischen Knoblauch Extrakt, ätherischen Knoblauchöl oder öligen Mazerat [6, 7].
Schwefelverbindungen zählen zu den wichtigsten Hauptbestandteilen des Knoblauchs. Die schwefelhältigen Aminosäuren, S-Alkyl-L-Cysteinsulfoxide, wie Alliin ein S-Allyl-L-(+)-cysteinsulfoxid und nicht flüchtige Peptide, die γ-Glutamyl-S-alkylcysteine wie γ-Glutamyl-S-trans-propenylcystein (0,35 bis 0,47%), γ-Glutamyl-S-allylcystein (0,24 bis 0,56%) und γ‑Glutamyl-S-methylcystein (0,06 bis 0,2%) machen mehr als 82% der Schwefelverbindungen aus [1, 6, 7]. Laut WHO Monographie enthält der frische Knoblauch 0,25 bis 1,15% und das unter milden Bedingungen getrocknete, hergestellte Knoblauchpulver 0,7 bis 1,7% Alliin [6].
Zudem enthält Knoblauch ätherische Öle mit einem Gehalt von 0,1 bis 0,36 %, Kohlenhydrate und Enzyme, wie die säure- und hitzelabile Alliinase, die Peroxidase oder Myronidase. Alliin selbst ist geruchlos und relativ stabil in der intakten Knoblauchzwiebel. Kommt es durch Zerdrücken, Zerkleinern oder anderwärtiger Bearbeitung der Knoblauchzehe zur Zerstörung der Zellstruktur, so wird Alliin aus dem Zytoplasma freigesetzt und interagiert mit der Alliinase, welche sich in benachbarten Vakuolen der Pflanzenzellen befindet. Durch Hydrolyse und sofortige Kondensation des reaktiven Zwischenprodukts Allylsulfensäure entsteht Allicin (Diallylthiosulfinat) [6]. Laut ESCOP Monographie entspricht 1 mg Alliin, 0,45 g Allicin [8]. Allicin ist mit einer Konzentration von 0,5 bis 2,5% im Knoblauchpulver enthalten und entspricht damit mehr als den im Europäischen Arzneibuch geforderten 0,45% [5].
Allicin selbst ist instabil und ein Ausgangsstoff vieler weiterer Umwandlungsprodukte wie E- und Z-Ajoene, Vinyldithiine (2-vinyl-(4H)-1,3-dithiin, 3-vinyl-(4H)-1,2-dithiin), Diallyl-Di- und Polysulfide (Diallyldisulfid, Diallyltrisulfid). Allicin und seine umgesetzten schwefelhaltigen flüchtigen Verbindungen sind für den typischen stechenden Geruch des Knoblauchs verantwortlich. Weiteres sind auch andere organische Thioverbindungen, Flavonoide (Apigenin, Allixin, Bergamottin, Myricetin, Nobiletin, Quercetin, Rutin, Tangeretin), Sapogenine und Saponine (β-Chlorogenin, Erubosid B, Protoerubosid B, Isoerubosid B, Protoisoerubosid B, Sativosid B1-5, R1, R2), Selen, Fructane, Aminosäuren (L-Cystein, L‑Methionin), Allithiamin und Adenosin im Knoblauch enthalten [7, 8].
Als Teil der Volksmedizin, ist Knoblauch schon seit tausenden Jahren eine der ältesten aller kultivierten Pflanzen, wobei sein Gebrauch bis in die Antike zurückführt. Die Ägypter erwähnten Knoblauch als effektives Heilmittel gegen eine Vielzahl von Krankheiten wie Kopfschmerzen, Herzleiden, Wurmbefall, Bisswunden und Tumore, im Codex Ebers, einem medizinischen Papyrus um 1550 v. Chr. [9]. Aber auch an den Wänden von alten ägyptischen Pyramiden und griechischen Tempeln fand man Aufzeichnungen über Knoblauch. Knoblauch wurde seit Jahrhunderten auf verschiedene Weise weltweit als Heilmittel verwendet. Zudem wird die arzneiliche Anwendung von Knoblauch in medizinischen Texten der Länder Indien, China, Griechenland sowie Rom beschrieben. Auch in der Bibel wird der Knoblauch beim Auszug der Juden aus Ägypten erwähnt [10]. Der griechische Arzt Hippokrates, der „Vater der Medizin“, sowie der griechische Naturwissenschaftler Aristoteles und Galen verwendeten Knoblauch als wichtigen Bestandteil zur Therapie von krankhaften Beschwerden sowie zur Erhaltung der Gesundheit. Es wurden Aufzeichnungen gefunden, in denen Knoblauch als vermutlich erstes leistungssteigerndes Mittel wettstreitenden Athleten bei den Olympischen Spielen verabreicht wurde. Im Mittelalter konnte Hildegard von Bingen von Knoblauch Gebrauch machen. Zu der Zeit wurde Knoblauch auch zur Abwehr von bösen Geistern, Vampiren oder Hexen angewendet. Buddhistischen Mönchen aus China war die Einnahme von Knoblauch jedoch strikt verboten, da ihm aphrodisierende Wirkungen zugeschrieben werden [4].
Die ESCOP Monographie von 2003 gibt die Verwendung von Knoblauch zur Prophylaxe von Arteriosklerose sowie zur unterstützenden diätetischen Vorsorge bei erhöhten Blutfettwerten an. Zudem kann Knoblauch bei Infektionen der oberen Atemwege und Katarrhen angewendet werden, jedoch sind für diese Indikationen keine klinischen Studien vorhanden [8]. In der WHO Monographie von 1999 ist der Gebrauch von Knoblauch zur Vorbeugung von altersbedingten arteriosklerotischen Gefäßveränderungen, als Hilfsstoff diätetischer Maßnahmen zur Behandlung von Hyperlipidämie und zur Therapie von leichtem Bluthochdruck beschrieben, welcher durch klinische Daten gestützt wird [6]. Die Behandlung von Atemwegs- und Harnwegsinfektionen, rheumatischen Beschwerden, Ringelflechte (Hautpilz-Infektion) oder als Karminativum bei Verdauungsstörungen mit Knoblauch ist in Monographien und traditionellen Medizinsystemen beschrieben [6].
Es liegen nicht genügend experimentelle und klinische Daten vor, die den Gebrauch von Knoblauch als Aphrodisiakum, Diuretikum, Antipyretikum, Emmenagogum, Expektorans, Sedativum, sowie als Mittel zur Behandlung von Asthma und Bronchitis und Förderung des Haarwuchses, welche in der Volksmedizin Verwendung finden, belegen [6].
Die therapeutische Verwendungen der Droge als Hilfsmittel zur Vorbeugung von Arteriosklerose sowie zur Linderung von Erkältungssymptomen wird in der Monographie des Ausschusses für pflanzliche Arzneimittel (HMPC) beschrieben und basiert ausschließlich auf langjähriger Erfahrung im Bereich der traditionellen Medizin [11].
Laut Directive 2001/83/EC kommen folgende Pflanzenpräparate zur Anwendung:
a) Die pulverisierte Droge
b) Der Flüssigextrakt der frischen Knoblauchzwiebel (DEV: 2-3:1), Extraktionsmittel: Raffiniertes Rapsöl
c) Der Trockenextrakt (DEV: 5:1), Extraktionsmittel: Ethanol 34% (V/V)
Die Zubereitungen in fester Dosierungsform sind zum oralen Gebrauch vorgesehen.
Als Hilfsmittel zur Vorbeugung von Arteriosklerose gibt die EMA folgende Dosierungen für Erwachsene und ältere Personen an:
a) Einzeldosis: 300 mg – 750 mg
Tagesdosis: 900 mg – 1380 mg (geteilt in 3 – 5 x täglich)
b) Einzeldosis: 110 – 220 mg, 4 x täglich
Tagesdosis: 440 – 880 mg
Die Anwendung bei Kinder und Jugendlichen unter 18 Jahren wird nicht empfohlen.
Zur Linderung von Erkältungssymptomen empfiehlt die EMA folgende Dosierung für Jugendliche, Erwachsene und Ältere:
c) Einzeldosis: 100 – 200 mg, 1 – 2 x täglich
Tagesdosis: 100 – 400 mg
Die Anwendung bei Kindern unter 12 Jahren wird nicht empfohlen.
Um ärztlichen Rat sollte gefragt werden, wenn die Symptome länger als 1 Woche andauern [11].
Generell kann Knoblauch als sehr sicher eingestuft werden. Dennoch liegen einige Daten zu häufig auftretende Nebenwirkungen vor, sowie Berichte über seltene Fälle von unerwünschten Wirkungen [12].
Unerwünschte Wirkungen
Die am Häufigsten auftretenden und wohl am meisten dokumentierten Nebeneffekte von oral aufgenommenem Knoblauch sind die übelriechenden Veränderungen von Atemluft und Haut. Bei Verzehr von großen Mengen an rohem Knoblauch, besonders auf leeren Magen, können Bauchschmerzen, Flatulenz und Veränderungen der Darmflora verursacht werden [12, 13]. Anorexia, Volligkeitsgefühl, Kopfschmerzen, Schwindel und übermäßiges Schwitzen werden als unerwünschte Wirkung in der European Union Herbal Monographie der EMA angegeben [11].
Borelli et al. berichten in ihrem Review über allergische Reaktionen wie Urtikaria, Kontaktdermatitis, fotoallergische Reaktionen, Rhinitis, Asthma, aber auch über Pemphigus und Angioödeme die als unerwünschte Wirkung bei topischer Anwendung oder bei oraler Einnahme von Knoblauch auftreten. Zudem wird in diesem Bericht eine Zusammenfassung vieler Studien und Fallreports vorgelegt die über das Auftreten von Hautmanifestationen wie Irritationen, Verbrennungen und Blasenbildung unter verschlossenen Verbänden durch die Anwendung von frischem Knoblauch auf der Haut schildern [12]. In einem Fall, der sich in China ereignete, wurde bei einem an Arzneimittel- und Lebensmittelallergie leidenden Patienten über eine Anaphylaxie, verursacht durch die Einnahme von frischem Knoblauch, berichtet [14].
Über die Häufigkeit des Auftretens dieser unerwünschten Wirkungen und die Knoblauchpräparate, bei denen diese Nebenwirkungen auftraten, liegen keine Daten vor [15].
Gegenanzeigen/Anwendungsbeschränkungen
Durch die aktiven Inhaltsstoffe des Knoblauchs, kann es zu Überempfindlichkeitsreaktionen kommen [11].
Laut WHO und ESCOP Monographie besteht kein Grund des Einwandes, die Droge in der Schwangerschaft und Stillzeit einnehmen zu können. Da jedoch keine ausreichenden Daten zur Sicherheit der Anwendung von Arzneimitteln die Knoblauch enthalten, während der Schwangerschaft und Stillzeit vorliegen, wird die Einnahme von Knoblauch nicht empfohlen [6, 8]. Es liegt eine Studie vor, in der beobachtet wurde, dass Säuglinge ein verbessertes Trinkverhalten bei stillenden Müttern die Knoblauchpräparate einnahmen, zeigten [16].
Wechselwirkungen
Diverse Studien berichten über den verstärkten antithrombotischen Effekt, der durch die gleichzeitige Einnahme von Knoblauch und Antikoagulantien (z.B.: Warfarin) oder thrombozytenaggregationshemmende Mitteln (z.B.: Aspirin®) zustande kommt und wodurch das Blutungsrisiko erhöht werden kann [17, 18]. In einer Studie jedoch wird ein Extrakt aus gereiftem Knoblauch (Kyolic®) als relativ sicher eingestuft, da kein ernsthaft erhöhtes Blutungsrisiko bei den Patienten unter der Warfarin Therapie beobachtet werden konnte [19]. Aufgrund der gleichen Auswirkung ist Vorsicht bei der Einnahme von Knoblauch und Nicht-steroidalen Antirheumatika geboten [20]. Einige Fallberichte legten offen, dass bei übermäßigem Konsum von Produkten die Knoblauch enthielten, eine Verlängerung der Blutungs- und Gerinnungszeit beobachtet wurde [21–23]. Ebenso sollte die Einnahme von Knoblauch 7‑10 Tage vor einer Operation vermieden werden, da das Risiko einer Post-operativen Blutung erhöht sein kann [24].
In einer Studie konnte ein starker Rückgang der Plasma Konzentration (Reduktion der Parameter AUC um 51%, C8 um 49% und Cmax um 54%) von Saquinavir (Fortovase; Roche Laboratories), einem HIV-1 Proteaseinhibitor, nach einer 3-wöchigen Gabe mit 3 x tgl., 1200 mg Dosierung und zusätzlicher Gabe von insgesamt 41 Dosen, 2 x tgl. Verabreichung von Knoblauch Kapseln (GarliPure®, Maximum Allicin Formula; Natrol) an gesunden Studienteilnehmern festgestellt werden [25]. Eine andere Studie zeigte, dass es bei einer 4‑tägigen (2 x tgl.) Einnahme von Knoblauch Weichgelatinekapseln (5 mg Knoblauch Extrakt; Natural Source Odourless Garlic Life Brand) und einer Einzeldosis von 400 mg Ritonavir (Novir; Abbott Laboratories) zu keiner signifikanten Veränderung der Pharmakokinetik der Einzeldosis vom Proteaseinhibitor Ritonavir in gesunden Teilnehmern kam, dennoch war eine Tendenz in Richtung der Reduktion der Plasmakonzentration von Ritonavir zu erkennen [26]. Von der FDA Amerika wird aufgrund der möglichen verminderten antiretroviralen Wirkung von Saquinavir, die gleichzeitige Einnahme von HIV-Proteaseinhibitoren und Knoblauchpräparaten daher nicht empfohlen [5].
Toxikologie
Ein nicht genau definierter Knoblauchextrakt führte in Mäusen und Ratten bei oraler, intraperitonealer und subkutaner Verabreichung zu einem LD50-Wert von mehr als 30 ml/kg [27]. Die akute Toxizität von wässrigem Knoblauchextrakt (100‑1600 mg/kg) wurde an Ratten getestet und der intraperitoneale LD50-Wert betrug 625,08 mg/kg [28]. Die 3-wöchige Verabreichung von 5 ml/kg frischen Knoblauchsaft an Ratten, führte zu Gewichtsverlust und einer schweren Schädigung der Magen-Darmschleimhaut. Nach bereits drei bis acht Tagen kam es zu einer Schwellung der Leber, einer Hypertrophie der Milz und Nebennieren und zu einer Verminderung der Erythrozyten. Nach 21 Tagen starben fünf Ratten aufgrund der schweren Magenverletzungen [29]. Es liegen widersprüchliche Angaben zur Beeinflussung der Fertilität durch verschiedene Knoblauchpräparate vor. Einerseits ergaben Untersuchungen an Ratten zur Beeinträchtigung der Fruchtbarkeit, nach oraler Verabreichung von 50 mg Knoblauchpulver über 45 oder 70 Tage oder von 5, 10, 15 und 30% rohen Knoblauch über 30 Tage lang, eine testikuläre Toxizität, welche sich durch eine Veränderung der Hodenfunktion, Verminderung der Spermatogenese, Reduktion des Testosteronspiegels, degenerative Verkleinerung der Hodenkanälchen, geschrumpfte Leydig-Zellkerne und Veränderung der Sertoli-Zellen, zu erkennen gab [30, 31]. Zudem verursachte die Verabreichung von 10 und 15% rohen Knoblauch an Ratten, eine Veränderung der akzessorischen Drüsen wie Prostata, Bläschendrüse und Nebenhoden, die durch die Hemmung der Expression von steroidogenen Enzymen der Leydig-Zellen und einer Hemmung der Sertoli-Zell-Marker einhergingen [32]. Nicht genauer definierte wässrige und ethanolische Knoblauchextrakte induzierten die Apoptose von testikulären Keimzellen [33], 20% von unverarbeitetem Knoblauch auch Leydig-Zellen, Sertoli-Zellen und Myoidzellen [34]. Andererseits konnte in einer Studie festgestellt werden, dass sich die 13‑tägige Verabreichung von verschiedenen Knoblauchzubereitungen wie frischer und gewärmter Knoblauchsaft, Knoblauchpulver und Extrakte aus gereiftem Knoblauch (4 ml/kg/Tag) positiv auf die durch warmes Wasser ausgelöste Impotenz und Hypospermatogenese in Mäusen auswirkte [35]. Eine Heilung des durch EDTA (Ethylendiamintetraessigsäure) degenerierten Hodengewebes konnte durch die Behandlung mit 5 ml/kg rohen Knoblauch in Ratten erzielt werden [36]. In einer in vitro Studie zur Gentoxizität die mit Knoblauchsaft (0,05%, v/v) in einer CHO-K1-BH4 Zelllinie durchgeführt wurde, konnte eine Hemmung des Zellwachstums, sowie Chromosomenaberrationen wie Brüche und Austausche in Chromatiden beobachtet werden [37]. Im Vergleich zur kontrollierten Gruppe, konnte jedoch in Mäusen unter oraler Gabe von 2,5, 5 und 7,5 g/kg Knoblauchpulver keine toxische Veränderung an Knochenmarkszellen, gefunden werden [38].
Knoblauch-Zubereitungen gehören zu den am besten und häufigsten erforschten Phytopharmaka und aufgrund der zahlreichen medizinischen Eigenschaften der Droge liegen unzählige klinische in vivo und in vitro, sowie epidemiologische Studien vor [39]. Im Wesentlichen sind die unterschiedlichen pharmakologischen Effekte dem Inhaltsstoff Allicin und seinen Umwandlungsprodukten zuzuschreiben.
Cholesterinsenkende Wirkung und antiatherogene Effekte
In vitro Studien
Es konnte ein Cholesterinsenkender Effekt durch die Hemmung der Cholesterinbiosynthese mittels Behandlung von hohen Konzentrationen an Knoblauchextrakten (Petroleumether-, Methanol- und Wasserextrakte von frischen Knoblauch), sowie S-allylcystein hältigen Knoblauchpräparaten in Rattenhepatozyten in Primärkulturen gezeigt werden [40]. Mit einem standardisierten Knoblauchpulver ( 1,3% Alliin) konnte eine konzentrationsabhängige Hemmung der Cholesterinbiosynthese zu unterschiedlichen enzymatischen Zwischenstufen beobachtet werden. Bei niedriger Konzentration verringert sich der 14C-Acetat-Einbau während der Cholesterinbiosynthese in kultivierten primären Hepatozyten von männlichen Sprague-Dawley-Ratten um 23%, mit einem IC50-Wert von 90 µg/ml und in menschlichen HepG2‑Zellen um 28%, mit einem IC50-Wert von 35 µg/ml. Die Hemmung der Cholesterinbiosynthese findet auf der Ebene der HMG-CoA-Reduktase statt, dem Schlüsselenzym der Cholesterinbiosynthese. Allicin und Ajoene sind für die Hemmung der HMG-CoA-Reduktase und somit für die Verringerung des 14C-Acetat-Einbaus in Sterole verantwortlich [41, 42]. Mit einem wässrigen Extrakt aus standarisiertem Knoblauchpulver (Tabletten, 300 mg, 1,3% Alliin) konnte eine 26%ige Reduktion an Cholesterinester und 32%ige Reduktion an freiem Cholesterin während einer 24 Stunden Inkubation in glatten Muskelzellen der menschlichen arteriosklerotischen Aorta (P < 0,05), sowie eine Hemmung der Aktivität der Proliferation dieser Zellen um 55% (1 mg/ml) beobachtet werden [43].
In vivo Studien
Nach 6-wöchiger täglicher oraler Aufnahme des wässrigen Extraktes von standardisiertem Knoblauchpulver (50 mg/kg KG, 1,3% Alliin, entsprechend 0,6% Allicin) reduzierte sich der Blutcholesterin- und Triglyceridwert in weiblichen Ratten mit Hypercholesterinämie [44]. In männlichen neuseeländischen Hasen mit einem durch 2% cholesterinreiche Nahrung hervorgerufenen hohen Blutcholesterinspiegel, konnte nach 28-tägiger zusätzlicher oraler Gabe von 2% Knoblauch eine signifikante Reduktion des Gesamtcholesterins um 50%, des HDL-Cholesterins um 64% und des LDL-Cholesterins um 50% beobachtet werden [45]. Es hat sich gezeigt, dass ein Allicin-haltiger Knoblauchextrakt (90 mg/kg KG) die Entstehung von Fettablagerungen in C57BL/6 Mäusen mit erhöhten Blutfettwerten verringern kann [46]. Im Vergleich zur unbehandelten Kontrollgruppe war am isolierten perfundierten Herzen nach Langendorff von Ratten, die zehn Wochen lang mit 1% Knoblauchpulver (1,3% Alliin) gefüttert wurden, eine signifikante Abnahme der Größe des ischämischen Bereichs (32% vs. 41%, P < 0,05 des gesamten Herzgewebes), des Auftretens ventrikulärer Tachykardie (0% vs. 35%, P < 0,05) und des Auftretens von Kammerflimmern (50% vs. 90%, P < 0,05) zu erkennen [47]. In einer Studie konnte eine deutliche Reduktion der Aktivität des Cholesterinester-Transferproteins (P < 0,05), eine Verringerung der Konzentrationen von Gesamtcholesterin, LDL, VLDL (P < 0,05), sowie eine Erhöhung der HDL-Konzentration (P < 0,05) in mit 1% Cholesterin und 1% gefriergetrocknetem Knoblauchpulver gefütterten Hasen über eine Behandlungsdauer von 12 Wochen, im Vergleich zur Kontrollgruppe gezeigt werden. Zudem war der Bereich mit arteriosklerotischen Läsionen in den Aortenbögen in der mit Knoblauch gefütterten Gruppe geringer als in der Kontrollgruppe (P < 0,05) [48]. Die durch eine Gefrierverletzung hervorgerufene lokale Verdickung der Aorten-Intima von Cholesterin-gefütterten Hasen, die mit 300 mg standardisiertem Knoblauchpulver (Allicor®, entsprechend 0,7% Allicin) 35 Tage lang behandelt wurden, war 1,5-fach dünner als die der Kontrollgruppe. Da Knoblauchpräparate die Konzentration an freien oder veresterten Cholesterin, Triglyceriden, Phospholipiden und Kollagen in der Neointima verringern, konnte auch eine 2‑fache Reduktion des Zellinhaltes der Hasen Aorten-Intima im Vergleich zur Kontrolle beobachtet werden (P < 0,05) [49].
Antihypertensive Wirkung und Effekte auf den Gefäßwiderstand
Die antihypertensive Wirkung des Knoblauchs konnte in in vivo Studien gezeigt werden.
Der zwei Wochen lang oral verabreichte wässrige Knoblauchextrakt mit einer Einzel- oder Mehrfachdosis von 0,5 ml (50 mg/kg KG) zeigte in 2-Nieren/1-Clip Goldblatt Modell Ratten mit Bluthochdruck eine signifikante blutdrucksenkende Wirkung (P < 0,05) [50]. Die Zugabe von 0,5% Knoblauchpulver (1,3% Alliin) zur normalen Fütterung von Ratten mit Hypertension, bewirkte eine Verlängerung der Lebensdauer um 22 Tage, verglichen mit 435 Tagen Lebenserwartung der Kontrollgruppe (P < 0,02) und eine eindeutige Abnahme des systolischen Blutdrucks um durchschnittlich 5,0 mmHg (P < 0,01), im Vergleich zur Kontrollgruppe [51]. Alkoholische und wässrige Knoblauchextrakte (1%) aktivieren die NO- (Stickstoffmonoxid)-Synthase, wodurch eine verstärkte Produktion von NO und Folge dessen eine Gefäßerweiterung und Blutdrucksenkung zustande kommt. Zudem wurde eine Hemmung der durch Adrenalin- und ADP (Adenosin-di-phosphat)-induzierte Thrombozytenaggregation beobachtet [52]. Die enterale Gabe einer Knoblauchlösung aus dehydriertem Knoblauchpulver (Pure-Gar, Tacoma, 100 mg/kg KG) für fünf Tage lang, führt zu einer vollständigen Hemmung der akuten hypoxischen pulmonalen Vasokonstriktion in Ratten, infolge der durch Knoblauch hervorgerufenen Dosis-abhängigen Vasorelaxation in intaktem oder geschädigtem Endothel pulmonaler Arterien [53]. 500 µg/ml des wässrigen Knoblauchextraktes (Pure-Gar, 1:9 Verdünnung) führten zu einer NO-abhängigen Vasodilatation, durch Hemmung des vasokonstriktorisch wirkenden Endothelin-1 [54].
Thrombozytenaggregationshemmende Wirkung, fibrinolytische Aktivität
In vitro Studien
Inhaltsstoffe des Knoblauchs wie Adenosin (IC50: 0,11 µg/ml) und andere organische Schwefelverbindungen, besonders das aus Alliin entstandene Allicin (IC50: 14 µg/ml), hemmen die Kollagen-induzierte Thrombozytenaggregation im plättchenreichen Plasma. So erzielt ein wässriger Knoblauchextrakt eine Thrombozytenaggregationshemmung mit einem IC50-Wert von 460 µg/ml [55]. Eine durch ADP (8 µmol/l) und Kalziumionophor A23187 (5 µmol/l) hervorgerufene Thrombozytenaggregation, sowie Kalziummobilisation konnte in Fura-2-Acetoxymethyl-(AM)-Ester beladenen Plättchen durch die Inkubation mit Extrakt aus gereiftem Knoblauch (25 %, v/v) für zehn Minuten bei 37 °C unterdrückt werden [56]. Durch die im Knoblauchöl enthaltenen Diallyldisulfide (40‑200 µg/ml) und Diallyltrisulfide (5‑100 µg/ml) konnte eine dosisabhängige Hemmung der durch verschiedene Agonisten wie Arachidonsäure, Adrenalin, Kollagen und Kalziumionophor A23187 induzierte Thrombozytenaggregation und Thromboxan B2-Bildung beobachtet werden [57]. In einer Studie konnte gezeigt werden, das ein wässriger und alkoholischer Knoblauchextrakt (10 mg/ml) die mittels ADP ausgelöste Thrombozytenaggregation deutlich gehemmt hat (P < 0,05). Die Hemmung der durch Adrenalin induzierten Thrombozytenaggregation war weniger deutlich [58]. Unter Zugabe von 500 und 1000 µg/ml Knoblauchlösung (geruchsloses Knoblauchpulver, gelöst in 0,01% Triton X-100, Bizen Chemical Co., Ltd.) zu einem Rinder-Fibrinfilm und synthetischen chromogenen Substrat konnte eine erhöhte Plasminogen-Aktivität gezeigt werden [59]. Im Rose-Bengal-Test wurde gezeigt, das ein Extrakt aus gereiftem Knoblauch in Konzentrationen zwischen 3,12% und 12,5% (v/v) die Bindung von Fibrinogen an den GPIIb/IIIa-(Glykoprotein-)Rezeptor im Vergleich zur Kontrolle um 40% hemmt (P < 0,05). Ebenso konnte eine Zunahme der intrazellulären cAMP-Konzentration im Vergleich zur Kontrolle (P < 0,01) beobachtet werden, wodurch die Thrombozytenaggreagtion gehemmt wird [60].
In vivo Studien
Die intravenöse Gabe einer Einzeldosis von 25 mg/kg KG Ajoene (ethanolischer Extrakt, suspendiert in Sojaöl) an Anubispavianen erzeugte eine totale Hemmung der durch ADP (10‑40 µM) und Kollagen (6,3‑25 µg/ml) induzierten Plättchenaggregation für zwei Stunden [61]. Als ein Index für die antithrombotische Wirksamkeit wurde der Serum Thromboxan B2 Spiegel in mit wässrigem Knoblauchextrakt (50‑500 mg/kg KG) für vier Wochen behandelten Ratten gemessen. Unabhängig von der Anwendungsart (oral oder intraperitoneal) konnte eine deutliche Senkung der TXB2 Spiegel beobachtet werden [62].
Antioxidative Wirkung
In vitro Studien
Die Wirkung als Radikalfänger konnte in einer Studie mit einem undefinierten Knoblauchpulver Präparat in menschlichen Granulozyten, welche mit 10 nM Phorbol-12-myristat-13-acetat (PMA) aktiviert wurden, beobachtet werden. Mit einem IC50‑Wert von 390 µg/ml hat das Knoblauchpräparat die Bildung von Superoxid-Anionen gehemmt [63]. Mittels Chemolumineszenz Methode ermittelt, zeigte der von 1 mg Knoblauchpulver gewonnene wässrige Extrakt die gleichen antioxidativen Eigenschaften wie 30 nmol Ascorbinsäure oder 3,6 nmol alpha-Tocopherol [64]. In Chemolumineszenz und 1,1-Diphenyl-2-Picrylhydrazyl (DPPH) Untersuchungen konnte ebenfalls die antioxidative Wirkung von S‑Allylcystein enthaltenen Präparaten beobachtet werden [65]. Die Studie an mit 1-4 mg/ml Extrakt aus gereiftem Knoblauch behandelten HUVEC Zellen (humane umbilikale venöse Endothelzellen), zeigte eine Expressionsinduktion der antioxidativ wirkenden Enzyme Hämoxygenase-1 und Glutamatcysteinligase, über die Aktivierung des Nrf2-Signalwegs [66].
In mehreren Studien konnte die antioxidative Wirkung unterschiedlicher Knoblauchpräparate, wie beispielsweise die durch Sauerstoffradikale und Lipidperoxidation bedingte Tumorbildung [67, 68], sowie Leber- [69] und Nierenschäden [70], Herz-Kreislauf-Erkrankungen [71] und Alterung [72] demonstriert werden. Extrakte aus gereiftem Knoblauch erhöhten die Aktivitäten von antioxidativ wirkenden Enzymen wie die Superoxid-Dismutase, die Katalase und die Glutathion-Peroxidase in Endothelzellen von Rindern [73].
Antimikrobielle Wirkung
Verschiedene Knoblauchpräparate wie ätherisches Knoblauchöl, wässriger oder ethanolischer Knoblauchextrakt oder frisch gepresster Knoblauchsaft zeigten in vitro eine wachstumshemmende Wirkung auf unterschiedliche gram-positive und gram-negative Bakterien wie Staphylococcus aureus, Streptococcus faecalis, Bacillus-Arten, Escherichia coli, Mycobacterium tuberculosis, Pasteurella multocida, Proteus-Arten, Pseudomonas aeruginosa, Pilze wie Aspergillus niger, Candida-Arten, Cryptococcus-Arten, Rhodotorula rubra, Shigella sonnei, Toruloposis-Arten, Trichosporon pullulans und Viren. Die antimikrobiellen Eigenschaften konnten dem aktiven Inhaltsstoff Allicin und seinen Umwandlungsprodukten zugeschrieben werden, welche durch Bindung an SH-Gruppen von Enzymen in Bakterien, Pilzen, Protozoen oder Viren eine Enzymhemmung nach sich ziehen [55, 74–85].
Blutzuckersenkende Wirkung
Nach oraler Verabreichung von 200 mg/kg KG Knoblauch in Streptozotocin- und Nikotinamid-induzierten diabetischen Ratten, konnte eine signifikante Reduktion der Hyperglykämie, durch eine um 26‑37% erhöhte Insulinproduktion beobachtet werden [86]. In einer Studie wurde eine deutliche Reduktion des Blutglucosespiegels, sowie des gemessenen glykosylierten Hämoglobins und eine Zunahme des Seruminsulins um 34% und 64% in Streptozotocin-induzierten diabetischen Ratten, welche mit 300 mg/kg oder 600 mg/kg KG Extrakt aus gereiftem Knoblauch behandelt wurden, festgestellt [87]. Zu einer Blutzuckersenkung kam es auch bei Ratten mit Diabetes, ausgelöst durch 60 mg/kg KG i.p. Streptozotocin, durch die 28‑tägige Behandlung mit jeweils 1000 mg/kg/5 ml (gelöst in Kochsalzlösung) rohem Knoblauchextrakt (P < 0,05), aber nicht durch Extrakt aus gereiftem Knoblauch und gekochtem Knoblauchextrakt [88]. Allerdings zeigten zwei ähnliche Studien negative Ergebnisse in Bezug auf die blutzuckersenkende Wirkung des Knoblauchs [89, 90].
Neuroprotektive Effekte
In einer erst kürzlich veröffentlichten Studie wurde der Effekt von 125, 250 und 500 mg/kg KG Extrakt aus gereiftem Knoblauch (30,96 % mg/g S-Allylcystein und 32 µg/g Allicin) an der durch 1 µl β-Amyloid (1-24) ausgelöste degenerative Dysfunktion und Neuroinflammation in Ratten untersucht. Mittels eines neuen Objekterkennungstest wurde die Merkfähigkeit der Ratten geprüft. Bei Dosen von 250 und 500 mg/kg KG des Extraktes konnte eine signifikante Verbesserung des Kurzzeitgedächtnisses in kognitiv eingeschränkten Ratten beobachtet werden. Im Vergleich zur Kontrollgruppe war eine Besserung der Neuroentzündung durch eine deutliche Verringerung der Dichte an immunreaktiven CD11b-positiven Mikrogliazellen und Zytokinen, wie Interleukin-1β in der Großhirnrinde und Hippocampus zu sehen. Das Ergebnis war vergleichbar mit dem Resultat, das durch die Behandlung der Ratten mit 10 mg/kg Celebrex®, einem entzündungshemmenden Schmerzmittels erzielt wurde [91]. Im Morris Wasserlabyrinth konnte gezeigt werden, dass Ratten, die täglich mit 2,5, 5 oder 10 mg/200 g KG Extrakt aus schwarzem Knoblauch, eine Form von fermentierten Knoblauch, gefüttert wurden, eine bessere Hirnleistung, sowie im Vergleich zu den kontrollierten Tieren eine höhere Anzahl neuronaler Zellen in der CA1 Region des Hippocampus aufwiesen [92]. Die Gabe von 150, 300 oder 450 mg/kg S-Allylcystein eine halbe Stunde vor der Applikation von 1 µl des Neurotoxins Quinolinsäure (240 nmol) erhielt die funktionelle und morphologische Integrität des Striatums in Ratten, durch den antioxidativen Effekt des im Knoblauch enthaltenen Stoffs [93]. Ebenso war bei C57BL/6J Mäusen der durch 1-Methyl-4-phenylpyridinium induzierte Dopaminverlust im Striatum mit der 17-tägigen S-Allycystein-Vorbehandlung (125 mg/kg i.p.) um 32% verringert und das Bewegungsverhalten bzw. die Bewegungsfähigkeit um 35% verbessert. Dies erfolgte durch den Anstieg der Aktivität der Cu‑Zn-Superoxid-Dismutase [94]. Nach der Verabreichung von 1,2 ml/kg KG Kyolic® Extrakt aus gereiftem Knoblauch i.p. an zerebralen Ischämie induzierten Ratten zu Beginn der 24 h Reperfusion war die Expression und Aktivität von TNF-α und Cyclooxygenase-2 (COX-2) geringer. Zudem verringerten sich die neurologischen Ausfallserscheinungen, das Infarktareal und die histologischen Veränderungen [95].
Cholesterinsenkende Wirkung
Die Wirkung des Knoblauchs auf den Gesamtcholesterinspiegel wurde in mehreren Metaanalysen [15, 96–100] beurteilt. In all diesen Metaanalysen konnte festgestellt werden, dass bei Patienten mit der Knoblauchtherapie im Vergleich zur Placebo-Gruppe eine deutliche Reduktion des Gesamtcholesterinwertes zu beobachten war. In einer 2012 publizierten Metaanalyse zu 26 randomisiert, doppelblinden und Placebo-kontrollierten Studien kam der Verfasser der Analyse zu dem Ergebnis, dass bei der Gruppe die die Behandlung mit Knoblauchpräparaten erhielt im Vergleich zur Placebo-Gruppe, eine Reduktion des Gesamtcholesterinspiegels von 0,28 mmol/L (95% CI, −0,45, −0,11) (P = 0.001) und eine Reduktion des Triglyceridwertes um 0,13 mmol/L (95% CI, −0,20, −0,06) (P < 0.001) beobachtet werden konnte. Die meisten Studien verwendeten Knoblauch Pulver (600 bis 900 mg/Tag), drei Studien verwendeten Knoblauchöl, vier Studien gealterten Knoblauchextrakt und die Anwendungsdauer reichte von zwei Wochen bis zu einem Jahr. Die Heterogenität unter den Studien betrug I2 = 64,2%, mittels Chi-Quadrat Test X2 = 61,43% [99]. Eine Reduktion des Gesamtcholesterinspiegels von 0,19 mmol/L (95% Cl, -0,33, -0.06) (7,35 mg/dl) und einer Senkung des Triglyceridwertes um 0,11 mmol/L (95% Cl, -0,19, -0,06) im Vergleich zur Placebo-kontrollierten Gruppe, konnte in der Metaanalyse aus dem Jahre 2009 zu 29 randomisiert und Placebo-kontrollierten Studien gezeigt werden [97]. Die Autorin Stevinson und Kollegen haben eine Metaanalyse erfasst in der nach den geforderten Kriterien wie randomisiert, doppelt verblindet und Placebo-kontrolliert, 13 Studien ermittelt wurden in denen Patienten mit Hypercholesterinämie, mit einem durchschnittlichen Gesamtcholesterin von 5,17 mmol/L (200 mg/dL) mit Knoblauchmonopräparaten (Zehn Studien davon verwendeten Tabletten mit standardisiertem Knoblauchpulver, mit 600, 800, 900 mg/Tag, eine Studie verwendete ätherisches Öl (0,25 mg/kg KG), eine Studie verwendete sprühgetrocknetes Pulver (700 mg/Tag) und eine weitere Studie verwendete wasserdampfdestilliertes Öl (10 mg/Tag)) und einer Anwendungsdauer variierend zwischen acht und 24 Wochen behandelt wurden. Im Vergleich zur Placebo-Gruppe war insgesamt eine Reduktion von -0,41 mmol/L (CI, -0,66 bis -0,15 mmol/L) (-15,7 mg/dL [CI, -25,6 bis -5,7 mg/dL]) (P < 0,01) des Gesamtcholesterins zu beobachten. Die Heterogenität der Studie mittels Chi-Quadrat Test ergab 36,76 [98]. In einer früheren Metaanalyse aus dem Jahr 1993 wurden Daten zu fünf ausgewählten randomisierten, Placebo-kontrollierten Studien mit Parallelgruppen-Design, an Patienten, von denen mindestens 75% einen erhöhten Gesamtcholesterinwert von 5,17 mmol/L (200 mg/dL) aufwiesen, quantitativ zusammengefasst. In drei Studien verabreichte man den Patienten Kwai® Tabletten (600, 800 und 900 mg/Tag), in einer Studie wurde Sprühgetrocknetes Pulver (700 mg/Tag) und in einer anderen Studie wässriger Extrakt (1000 mg/Tag) verwendet. Es wurde eine Reduktion von -0.59 mmol/L (CI, -0,74 bis -0,44 mmol/L) (22,8 mg/dL [CI, -28.6 bis ‑17.0 mg/dL]) beobachtet [96].
Antihypertensive Effekte
In einer aktuellen aktualisierten Meta-Analyse über die Auswirkung von Knoblauch auf den Blutdruck wurden randomisiert, kontrollierte Studien, die zwischen dem Jahr 1995 und 2013 veröffentlicht wurden, in Datenbanken gesucht. Die Analyse bezog 20 Studien mit 970 Teilnehmern ein. Im Vergleich zur Placebo-Gruppe zeigte sich bei den Gruppen die Zubereitungen aus Knoblauch erhielten, eine Senkung des mittleren systolischen Blutdrucks um 5 mmHg (P < 0,001; n = 19) und des mittleren diastolischen Blutdrucks um 3 mmHg (P < 0,001; n = 20). Bei Hypertonikern senkte sich der systolische Blutdruck um 9 mmHg (P < 0,001; n = 10) und der diastolische Blutdruck um 6 mmHg (P < 0,001; n = 6) [101]. Drei weitere Meta-Analysen aus dem Jahr 2015 [102–104], konnten durch die Meta-Analyse der Autorin Ried und Kollegen bestätigt werden. Die Mehrheit der Studien (n = 13) verwendeten standardisiertes Knoblauchpulver (600 bis 2400 mg/Tag) oder Extrakte aus gereiften Knoblauch (n = 5) (240, 480, 960, 2400, 3050 mg/Tag). Nur zwei Studien machten von anderen Knoblauchpräparaten (Knoblauchöl, Eidotterangereichertes Knoblauchpulver) Gebrauch [101].
Thrombozytenaggregationshemmende Wirkung
In einer randomisierten, doppelblinden, Placebo-kontrollierten Cross-Over Studie wurde bei 34 gesunden Teilnehmern die Wirkung von 2,4 bis 7,2 g Extrakt aus gereiftem Knoblauch pro Tag untersucht. Im zwei‑Wochen-Intervall, wurde die durch verschiedene Induktoren wie ADP, Adrenalin und Kollagen stimulierte Plättchenaggregation und Adhäsion, im Verlauf der Studie gemessen. Durch die Einnahme des Extraktes konnte eine nicht bei allen Induktoren dosisabhängige Thrombozytenaggregation beobachtet werden. Bereits niedrige Extraktdosen hemmten die Adhäsion der Thrombozyten an Fibrinogen. Mit der hohen Extraktdosis von 7,2 g pro Tag wurde das Anheften an den von Willebrandfaktor gehemmt [105]. An Jugendlichen mit einem erhöhten Risiko für ischämische Attacken konnte in einer randomisierten, doppelblinden und Placebo-kontrollierten Studie gezeigt werden, dass im Vergleich zur Placebo-Gruppe die Gruppe mit täglicher Einnahme von 800 mg Knoblauchpulver über vier Wochen lang zu einer signifikanten Senkung der Quote der zirkulierenden Plättchenaggregate um 10,3%, von 1,17 +/- 0,08° auf 1,05 +/- 0,11° (U Test, P < 0,01) und der spontanen Thrombozytenaggregation um 56,3% von 40,7 +/- 23,3° auf 17,8 +/- 23.2° (U Test, P < 0,01) führte [106]. Auch bei Patienten mit peripherer arteriellen Verschlusskrankheit im Stadium II, wurde durch die 12-wöchige Behandlung mit einer täglichen Dosis von 800 mg Knoblauchpulver eine Reduktion der spontanen Plättchenaggregation um 59% festgestellt. Zudem sank die Plasma Viskosität in der mit Knoblauch behandelten Gruppe um 3,6% und die Patienten konnten um 46 m längere schmerzfreie Gehstrecken zurücklegen, im Vergleich zur Placebo-Gruppe [107]. Ebenso besaß ein Extrakt aus gereiftem Knoblauch mit einer Dosis von 5 ml pro Tag eine hemmende Wirkung auf die ADP-stimulierte Thrombozytenaggregation [108].
Wirksamkeit bei Erkältungskrankheiten
Nur eine von acht Studien konnte in einer Cochrane Meta-Analyse zur Wirksamkeit von Knoblauchzubereitungen bei Erkältungskrankheiten einbezogen werden [109]. In dieser Studie erhielten 146 Teilnehmer entweder ein Knoblauchpräparat mit einem Gehalt von 180 mg Allicin pro Tag oder ein Placebo über 12 Wochen. Laut Selbstangaben kam es in der mit Knoblauch behandelten Gruppe zu 24 Erkältungsepisoden mit 111 Krankheitstagen, in der Placebo-Gruppe zu 65 Erkältungsepisoden mit 366 Krankheitstagen (P < 0,001). Der Krankheitsverlauf unterschied sich bei einer Erkrankung der Teilnehmer zwischen den beiden Gruppen nicht [110]. Nach der täglichen Einnahme von 2,56 g Extrakt aus gereiftem Knoblauch über drei Monate lang, konnte bei 120 Patienten in einer randomisierten, Placebo-kontrollierten Doppelblind-Studie eine bessere Proliferation von γδ-T-Zellen (P = 0,039, n = 56) und NK-Zellen (P = 0,043, n = 56) festgestellt werden, im Vergleich zu Placebo-kontrollierten Patienten. Obwohl kein signifikanter Unterschied in der Anzahl der Erkältungsepisoden zu erkennen war, so war bei den Personen in der Knoblauchgruppe eine um 21% (P < 0,001; z‑Test) geringere Schwere der Symptome zu erkennen. Ebenso verringerte sich die Anzahl der Tage um 61% (P < 0,001; z-Test) an denen die Betroffenen suboptimal funktionierten und die Anzahl der Tage mit Arbeits- bzw. Schulunfähigkeit um 58% (P < 0,035; z-Test) [111].
Blutzuckersenkende Wirkung
In einer 24-wöchigen Placebo-kontrollierten Einfachblind-Studie, wurde der Effekt von Knoblauch auf den Blutglucosespiegel und HbA1c an Typ-II Diabetikern untersucht. Dazu wurden 210 Teilnehmer in sieben Gruppen (A, B, C, D, E, F und G) zu je 30 Patienten unterteilt. Die Personen der Gruppen A, B, C, D und E erhielten täglich jeweils 300, 600, 900, 1200 und 1500 mg Knoblauchtabletten, Gruppe F nahm zweimal täglich 500 mg Metformin Tabletten ein und Gruppe G erhielt ein Placebo. Der Nüchternblutzucker und HbA1c wurde in der 0., 12. und 24. Woche gemessen. Im Vergleich zur Placebo-Gruppe, konnte in jeder mit Knoblauch behandelten Gruppe eine Dosis- und Dauer-abhängige Senkung des Nüchternblutzuckerspiegels (P < 0,005) und des HbA1c-Wertes (P < 0,005) beobachtet werden. Bei höheren Dosen an Knoblauch und einer längeren Behandlungsdauer, waren die Reduktion des Nüchternblutzuckers und die Verbesserung des HbA1c-Wertes hoch signifikant. Zur Senkung des Nüchternblutzuckerspiegels ist Knoblauch wirksamer als das Placebo und vergleichbar mit dem Antidiabetikum Metformin [112]. Die blutzuckersenkende Wirkung des Knoblauchs konnte auch in einer vier wöchigen randomisierten, Placebo-kontrollierten Doppelblind-Studie an 60 Teilnehmer mit Typ II-Diabetes mellitus gezeigt werden. Die Patienten erhielten entweder die Monotherapie mit Knoblauchtabletten mit einem Gehalt von 300 mg, eine Kombinationstherapie mit einem oralen Sulfanylharnstoff oder ein Placebo. Im Vergleich zur Placebo-Gruppe, konnte bei den beiden mit Knoblauch behandelten Gruppen eine Reduktion des Nüchternblutzuckerspiegels und Verbesserung der Blutzuckereinstellung wahrgenommen werden (P < 0,05) [113].


