Übersicht
Der Name „Cynara“ ist unbekannter Herkunft und bezeichnet die Gemüseartischocke. „Scolymus“ ist griechischen Ursprungs und hat einen Bezug zu „skolybos = essbare Zwiebel“.
Die Artischocke lässt sich von (Blüten-)Kopf bis (Blatt-)Grund umfassend nutzen: die inneren weichen Teile der Blütenstände (Blütenhüllblätter und der Blütenboden) eignen sich als mediterrane Vorspeise und zur Herstellung eines Aperitifs, die Grundblätter oder Laubblätter, frisch oder getrocknet, zur Herstellung von Arzneimitteln.
Als Droge werden die frischen oder getrockneten, ganzen oder geschnittenen Grundblätter genutzt, die zur Zeit der Blüte im August, kurz nach dem Aufblühen, geerntet werden.
Referenzen
1. Wagner H, Bladt S, Zgainski EM. Drogenanalyse, 1. Aufl., Springer, Heidelberg. 1983.
2. Shimoda H, Ninomiya K, Nishida N, Yoshino T, Morikawa T, Matsuda H, et al. Anti-hyperlipidemic sesquiterpenes and new sesquiterpene glycosides from the leaves of artichoke (Cynara scolymus L.): structure requirement and mode of action. Bioorg Med Chem Lett. 2003; 13: 223–228.
3. Wittemer SM, Veit M. Validated method for the determination of six metabolites derived from artichoke leaf extract in human plasma by high-performance liquid chromatography-coulometric-array detection. J Chromatogr B Analyt Technol Biomed Life Sci. 2003; 793: 367–375.
4. Brand N. Die Artischocke – eine Dekade interdisziplinärer Forschung. Zeitschrift für Phytotherapie. 1999; 20: 292–302.
5. Englisch W, Beckers C, Unkauf M, Ruepp M, Zinserling V. Efficacy of Artichoke dry extract in patients with hyperlipoproteinemia. Arzneimittelforschung. 2000; 50: 260–265. doi: 10.1055/s-0031-1300196.
6. Thompson Coon, Joanna S, Ernst E. Herbs for serum cholesterol reduction: a systematic view. J Fam Pract. 2003; 52: 468–478.
7. Wegener T, Fintelmann V. Pharmacological properties and therapeutic profile of artichoke (Cynara scolymus L.). Wien Med Wochenschr. 1999; 149: 241–247.
8. Adzet T, Camarasa J, Laguna JC. Hepatoprotective activity of polyphenolic compounds from Cynara scolymus against CCl4 toxicity in isolated rat hepatocytes. J Nat Prod. 1987; 50: 612–617.
9. Melzig MF, Funke I. Type 2 diabetes: A rationale indication for artichoke. Zeitschrift fur Phytotherapie. 2010; 31: 236–240. doi: 10.1055/s-0030-1262400.
10. Wider B, Pittler MH, Thompson-Coon J, Ernst E. Artichoke leaf extract for treating hypercholesterolaemia. Cochrane Database Syst Rev. 2013; 3: CD003335. doi: 10.1002/14651858.CD003335.pub3.
11. Wittemer SM, Ploch M, Windeck T, Muller SC, Drewelow B, Derendorf H, et al. Bioavailability and pharmacokinetics of caffeoylquinic acids and flavonoids after oral administration of Artichoke leaf extracts in humans. Phytomedicine. 2005; 12: 28–38. doi: 10.1016/j.phymed.2003.11.002.
12. BOHM K. Choleretic action of various plant drugs. Arzneimittelforschung. 1959; 9: 376–378.
13. Lietti A. Choleretic and cholesterol lowering properties of two artichoke extracts. Fitoterapia. 1977; 48: 153–158.
14. Saénz Rodriguez T, García Giménez D, De la Puerta Vázquez, R. Choleretic activity and biliary elimination of lipids and bile acids induced by an artichoke leaf extract in rats. Phytomedicine. 2002; 9: 687–693. doi: 10.1078/094471102321621278.
15. Maros T, Seres-Sturm L, Racz G, Rettegi C, Kovacs VV, Hints M. Effect of Cynara scolymus-extracts on the regeneration of rat liver. 2. Arzneimittelforschung. 1968; 18: 884–886.
16. Gebhardt R. Inhibition of cholesterol biosynthesis in primary cultured rat hepatocytes by artichoke (Cynara scolymus L.) extracts. J Pharmacol Exp Ther. 1998; 286: 1122–1128.
17. Gebhardt R, Fausel M. Antioxidant and hepatoprotective effects of artichoke extracts and constituents in cultured rat hepatocytes. Toxicol In Vitro. 1997; 11: 669–672.
18. Bundy R, Walker AF, Middleton RW, Wallis C, Simpson, Hugh C R. Artichoke leaf extract (Cynara scolymus) reduces plasma cholesterol in otherwise healthy hypercholesterolemic adults: a randomized, double blind placebo controlled trial. Phytomedicine. 2008; 15: 668–675. doi: 10.1016/j.phymed.2008.03.001.
19. Rondanelli M, Monteferrario F, Perna S, Faliva MA, Opizzi A. Health-promoting properties of artichoke in preventing cardiovascular disease by its lipidic and glycemic-reducing action. Monaldi Arch Chest Dis. 2013; 80: 17–26.
20. Rondanelli M, Giacosa A, Opizzi A, Faliva MA, Sala P, Perna S, et al. Beneficial effects of artichoke leaf extract supplementation on increasing HDL-cholesterol in subjects with primary mild hypercholesterolaemia: a double-blind, randomized, placebo-controlled trial. Int J Food Sci Nutr. 2013; 64: 7–15. doi: 10.3109/09637486.2012.700920.
21. Kirchhoff R, Beckers C, Kirchhoff GM, Trinczek-Gartner H, Petrowicz O, Reimann HJ. Increase in choleresis by means of artichoke extract. Phytomedicine. 1994; 1: 107–115. doi: 10.1016/S0944-7113(11)80027-9.
22. Holtmann G, Adam B, Haag S, Collet W, Grunewald E, Windeck T. Efficacy of artichoke leaf extract in the treatment of patients with functional dyspepsia: a six-week placebo-controlled, double-blind, multicentre trial. Aliment Pharmacol Ther. 2003; 18: 1099–1105.
23. Rondanelli M, Opizzi A, Faliva M, Sala P, Perna S, Riva A, et al. Metabolic management in overweight subjects with naive impaired fasting glycaemia by means of a highly standardized extract from cynara scolymus: A double-blind, placebo-controlled, randomized clinical trial. Phytotherapy Research. 2014; 28: 33–41. doi: 10.1002/ptr.4950.
24. Wider B, Pittler MH, Thompson-Coon J, Ernst E. Artichoke leaf extract for treating hypercholesterolaemia. Cochrane Database Syst Rev. 2009: CD003335. doi: 10.1002/14651858.CD003335.pub2.
Botanik
Cynara scolymus L. ist ein distelartiges, bis zu 2 m hohe Kraut und nur aus der Kultur bekannt. Das als Arzneidroge verwendete Blatt erreicht Abmessungen bis zu 50 cm und ist fiederspaltig geteilt. Die Fiederabschnitte sind gezähnt. Die Blattunterseite ist weißlich und bedeckt mit ineinander verschlungenen Haaren. Folglich erscheint die Schnittdroge als graugrüne, wollig-filzige Aggregate.
Die Pflanzen sind ausdauernd, aber leider nicht so frostresistent, dass sie in unseren Breiten problemlos im Freien durch den Winter kommen können. Deshalb konzentriert sich die Kultivierung von Artischocken auch auf das Mittelmeergebiet.
Droge
Für die Artischockenblätter (Cynarae folium) liegt eine Positiv-Monographie der Kommission E und der WHO vor.
Ein Trockenextrakt aus den frischen Blättern mit einem Drogen-Extrakt-Verhältnis von 15 – 35:1 und Wasser als Extraktionsmittel läuft gemäß European Medicines Agency (EMA) unter der Kategorie „traditional use“.
Die Blätter zur Gewinnung von Extrakten stammen zum Teil aus den Gemüsekulturen nach dem Abernten der Blütenköpfe oder aus speziellen Blattkulturen. Selbst eine schonende Lufttrocknung bei 40 °C führt bereits zu erheblichen Verlusten an Sesquiterpenlaktonen und Kaffeesäurederivaten durch blatteigene Enzymaktivitäten. Optimale Gehalte an Caffeoylchinasäuren (inkl. Cynarin) werden nur dann erreicht, wenn zur Herstellung der Extrakte Frischpflanzenmaterial verwendet wird und die Heißwasserextraktion bei 80 °C während 18 h durchgeführt wird.
Die Verteilung der Inhaltsstoffe auf die einzelnen Pflanzenteile ist unterschiedlich. Das Ausmaß der beobachteten Gehaltsschwankungen während der Vegetationsperiode ist abhängig von Standort und Kultivierung.
Als wertbestimmende Inhaltsstoffe werden Caffeoylchinasäuren und Sesquiterpene angesehen.
- Die Caffeoylchinasäurederivate werden in der Literatur als Hydroxyzimtsäuren, Kaffeesäurederivate, oder ortho-Dihydroxyphenole bezeichnet.
Sie sind in allen Pflanzenteilen enthalten.
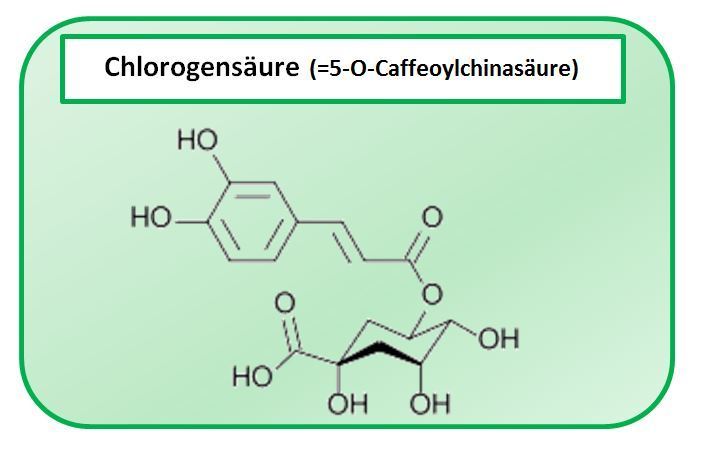
Laut Literatur liegt ein instabiles Gemisch aus Mono- und Di-Caffeoylchinasäuren vor (2,4 – 6,0 %), welches vor allem Chlorogensäure, 1,5-O-Dicaffeoylchinasäure und sehr wenig Cynarin (1,3-O-Dicaffeoylchinasäure) enthält. Das in den Auszügen enthaltene Cynarin entsteht aus 1,5-Dicaffeoylchinasäure durch die Behandlung der Droge mit heißem Wasser während des Extraktionsprozesses. Der wässrige Extrakt gibt somit nicht das genuine Caffeoylchinasäuren-Spektrum der Droge wieder. Bei Cynarin handelt es sich um ein Artefakt mit auffallend süßem Geschmack [Sticher und Wagner Bladt 1996 zitieren].
Außerdem ist die Benennung der Chinasäurederivate in der Literatur verwirrend, da meistens die traditionelle Bezeichnung, und nicht die IUPAC-Nomenklatur verwendet wird. Chlorogensäure ist gemäß IUPAC-Regeln eine 5-O-Caffeoylchinasäure (und traditionell 3-O-Caffeoylchinsäure). Die Moleküle liegen bevorzugt in der hier formulierten Sessel-Konformation vor.
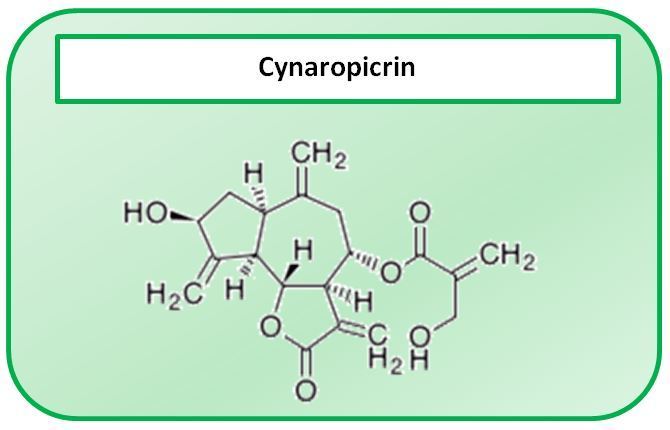
- Die Sesquiterpenlaktone vom Guajanolidtyp (bis 5 %) haben Bitterstoffcharakter. Sie befinden sich nur in den grünen Pflanzenteilen, vor allem in den Blattspreiten, nicht dagegen in Blattstielen, vollentwickelten Blüten und Früchten. Die Bitterstoffe werden von zahlreichen, ungeschützt auf der Blattoberseite lokalisierten Asteraceen-Drüsenhaaren sezerniert. Durch Regen oder Waschen der Blätter werden sie leicht entfernt [1]. Als Hauptkomponente kommt hier das Cynaropicrin vor [2]. Diese Substanz hat einen Bitterwert von 400.000, das bedeutet, dass 1 g Cynaropikrin 400 Liter Wasser bitter machen kann.
- Mit geringeren Anteilen an freiem Luteolin kommen die Flavonoide (0,35 – 0,75 %) vor allem als Glykoside vor: Luteolin-7-O-glucosid (Cynarosid), Luteolin-7-O-rutinosid (Scolymosid) und Luteolin-7-O-rutinosyl-4‘-O-glucosid (Cynarotriosid) [3].
- Außerdem sind verschiedene aliphatische Säuren, vor allem Hydroxysäuren (Milchsäure, Hydroxyessigsäure, Äpfelsäure, Hydroxymethylacrylsäure) und Kaffeesäure enthalten.
Die Heimat der Artischocke vermutet man in Äthiopien. Jedenfalls war die Pflanze den Römern und Ägyptern bekannt, geriet dann in Vergessenheit und wurde erst im 15. Jahrhundert wieder in Kultur genommen. Besonderen gesundheitlichen Wert sprach man in erster Linie der Wurzel und den Blättern zu, die schon im 16. Und 17. Jahrhundert als Mittel gegen „verstopfte Leber und Niere“ gepriesen wurden.
Als Medizinalwein wird Vinum Cynarae nicht nur bei Verdauungsbeschwerden, sondern auch als Roborans in der Rekonvaleszenz gerne getrunken. Das im Blütenboden reichlich vorhandene Polysaccharid Inulin macht die Artischocke zu einem wertvollen Diabetikergemüse.
Als wirksame Inhaltsstoffe der Artischockenblätter werden Caffeoylchinasäuren und Sesquiterpene angesehen, die choleretische, hepatoprotektive, antioxidative, cholesterol- und lipidsenkende Eigenschaften aufweisen.
Gesicherte Anwendungsgebiete nach ESCOP und EMA:
Zur symptomatischen Linderung von Verdauungsstörungen wie Dyspepsie mit einem Völlegefühl und Blähungen, vor allem wenn die Beschwerden auf Störungen des Leber-Galle-Systems zurückzuführen sind.
In pharmakologischen und klinischen Studien wurden nach Gabe der Droge eine signifikante Zunahme des Gallenflusses und die Besserung dyspeptischer Beschwerden (Blähungen, Bauchschmerzen, Übelkeit, Erbrechen, Völlegefühl) nachgewiesen. Ebenso wurde eine Senkung von erhöhten Cholesterolwerten, Triglyceriden, freien Fettsäuren, Phospholipiden und β-Lipoproteinen gezeigt. Das Verhältnis von LDL/HDL verbesserte sich nach Einnahme von Artischockenblättern. Eine durchschnittliche Senkung des Gesamtcholesterins um 10 – 20 % wurde in verschiedenen Studien festgestellt [4–7].
Gleichzeitig nehmen Artischockenzubereitungen auch Einfluss auf die Leber. Artischocke wirkt stimulierend auf die Zellteilung und die Durchblutung in der Leber wird erhöht. Dadurch kommt es insgesamt zu einer erhöhten Regeneration und leberschützenden Effekten [8]. Auch bei der Malariatherapie wird die Leberschutzwirkung der Artischocke genutzt [4].
Weitere Indikationen aufgrund experimenteller und klinischer Studien:
- Appetitlosigkeit
- (prä-)arteriosklerotische Krankheitsbilder
- vorbeugend gegen Gallensteinrezidive
- Diabetes mellitus Typ 2 (Hemmung der α-Amylase-Aktivität) [9]
Verwendet werden überwiegend Fertigpräparate, in der Regel aus wässrigen Trockenextrakten. Erhältlich sind Dragees, Kapseln, Tabletten oder Tropfen. Auch der Presssaft aus der frischen Pflanze ist für die medizinische Verwendung geeignet.
Empfohlen werden Tagesdosen, die 6 g getrockneter Droge entsprechen (ca. 1320 mg wässriger Trockenextrakt (DEV 2.5-7.5:1) oder 10 mL Presssaft), verteilt auf 2 – 3 Portionen, jeweils vor den Mahlzeiten [10].
Für den Trockenextrakt aus den frischen Blättern mit einem Drogen-Extrakt-Verhältnis von 15 – 35:1 und Wasser als Extraktionsmittel, gilt laut EMA (European Medicines Agency, EMA/HMPC/150218/2009) „traditional use“ mit einer Tagesdosis von 900 – 2400 mg in aufgeteilten Dosen von 300 – 600 mg.
Die Artischocke eignet sich hervorragend zur Dauer- und Langzeitanwendung.
Artischocken als Gemüse besitzen keine gute arzneiliche Wirksamkeit, da die Zubereitung ihnen einen großen Teil der wirksamen Inhaltsstoffe entzieht.
Die lange medizinische Anwendung sowie die weit verbreitete Verwendung in der Küche belegen das gute Sicherheitsprofil von Zubereitungen aus der Artischocke.
Unerwünschte WirkungenBei bestimmungsgemäßer Anwendung sind keine Nebenwirkungen bekannt. Ein allergisches Kontaktekzem vor allem der Hände wird als gelegentliche Berufskrankheit bei Artischockenpflückern, Gemüsehändlern und Küchenpersonal beobachtet.
Gegenanzeigen/Anwendungsbeschränkungen
Vorsicht bei der Anwendung ist geboten für Personen, die an einer Allergie gegen Pflanzen aus der Familie der Korbblütler leiden. Aufgrund der choleretischen Wirkung ist eine Anwendung bei Verschluss der Gallenwege oder bei Gallensteinen kontraindiziert.
Wechselwirkungen
Es sind keine Wechselwirkungen bekannt.
Pharmakokinetik und Metabolismus
Bioverfügbarkeit:
Nach oraler Verabreichung von 2,4 g ALE („artichoke leaf extract“; wässriger Trockenextrakt) mit 149,3 mg Caffeoylchinasäuren und 22,6 mg Luteolin-7-O-glucosid an 14 Probanden konnten nach enzymatischer Spaltung der vorliegenden Phase-II-Konjugate Kaffeesäure (KS), Dihydrokaffeesäure (DHKS), Ferulasäure (FS), Dihydroferulasäure (DHFS), Isoferulasäure (IFS) und Luteolin im Plasma nachgewiesen werden. [11]
Plasma-Konzentrationsbereich und Eliminationshalbwertszeit:
Der Vergleich der maximalen Plasmaspiegel (Cmax) und der Eliminationshalbwertszeit (t1/2) zeigt, dass die einzelnen Hydroxyzimtsäuren in zwei Gruppen eingeteilt werden können. Nach der enzymatischen Spaltung der Konjugate wurden für KF, FS und IFS Cmax nach 1 h gemessen (KS: 6,5 ±1,9 ng/mL; FS 8,9 ± 1,7 ng/mL; IFS: 7,9 ± 2,2 ng/mL). Für DHKS und DHFS wurden etwa um einen Drittel höhere Cmax-Werte 6 – 7 h nach Applikation gemessen (DHKS: 21,3 ± 12,4 ng/mL; DHFS: 27,6 ± 13,8 ng/mL). Aufgrund der verschiedenen tmax-Werte (tmax = Zeit bis zum Erreichen von cmax) von 1 bzw. 6 – 7 h wird postuliert, dass die Absorption von KS, FS und IFS im Dünndarm stattfindet, während DHKS und DHFS im Kolon absorbiert werden.
Luteolin-Konjugate waren bereits 15 min nach Applikation von ALE im Plasma nachweisbar.
Maximale Plasmaspiegel des Luteolins mit 59,1 ± 32,8 ng/mL wurden nach 30 – 40 min erreicht. Die t1/2 betrug etwa 2,5 h. [11]
Ausscheidung renal
Der Anteil an renal eliminierten Caffeoylchinasäurederivaten betrug 4 – 5 % (berechnet als Kaffeesäureäquivalente). Den Hauptanteil bildeten FS- und DHFS-Konjugate sowie DHFS. Aufgrund eines deutlich ausgeprägten biphasischen Eliminationsprofils resultierte für FS mit ca. 6 h eine im Vergleich zu den anderen Hydroxyzimtsäuren etwa doppelt so lange t1/2.
Bezogen auf die verabreichte Luteolin-Dosis wurden ca. 2 % in Form von Luteolin-Konjugaten renal eliminiert. [11]
Wirkungen
Neben der Bitterwirkung und der choleretischen Wirkung zeigt der wässrige Trockenextrakt aus Artischockenblättern auch eine antioxidative und eine lipidsenkende Wirkung.
Die 3 wichtigsten Wirkungen (inkl. der Einsatzgebiete):
- Choleretische Wirkung (- beim dyspeptischen Symptomenkomplex)
Die Steigerung der Sekretion von Gallenflüssigkeit (Cholerese) gilt als eines der wesentlichen Wirkprinzipien bei der Behandlung dyspeptischer Verdauungsstörungen. Verantwortlich dafür sind die Caffeoylchinasäuren, speziell die Chlorogensäure sowie das Cynarin und Luteolin-7-O-glucosid.
Alkoholische Trockenextrakte steigerten bei der Ratte die Gallenproduktion um 20 bis 40 %. Zwei wässrig-alkoholische Extrakte mit 19 % sowie 46 % Caffeoylchinasäurederivaten wurden Ratten zu 200 mg/kg sowie 25 mg/kg intraperitoneal verabreicht. Das Volumen und der Trockenrückstand der Gallenflüssigkeit nahmen in Abhängigkeit von der Caffeoylchinasäuredosis zu [12–14].
- Antioxidative Wirkung (- zur Zellmembranprotektion)
Der Artischockentrockenextrakt ist auch in der Lage, eine oxidative Schädigung der Leberzellmembran durch tertiäres Butylhydroperoxid zu verhindern. Daraus sowie aus weiteren in-vitro und in-vivo Experimenten wird auch eine hepatoprotektive Wirkung abgeleitet.
Ratten erhielten vor und nach partieller Hepatektomie täglich oral eine 2,5 g Droge entsprechende Menge eines angereicherten Blattextraktes. An ihren Lebern waren eine Gewichts- und Durchblutungszunahme, eine Mobilisierung der Energiereserven und eine Steigerung der Proteinbiosynthese feststellbar. Daraus wurde eine Stimulierung der Leberregeneration abgeleitet [15].Für diese antioxidative Wirkung sind die phenolischen Substanzen mit einer o-Hydrochinon-Partialstruktur (unter anderem Luteolin, Luteolinglykoside, Caffeoylchinasäuren) verantwortlich.
- Hemmung der Cholesterolbiosynthese (- zur Arterioskleroseprävention)
Die Hemmung der Neusynthese von Cholesterol auf der Stufe der HMG-CoA-Reduktase (Schlüsselenzym der Cholesterolbiosynthese) sowie eine verstärkte Cholesterolausscheidung in Form von Gallensäuren mittels gesteigerter Cholerese stellen die Hauptmechanismen der lipidsenkenden Wirkung dar. Durch die Cholerese wird außerdem die Darmperistaltik angeregt. Das Luteolin, das nach enzymatischer Freisetzung aus den Flavonoidglykosiden entsteht ist in erster Linie für den lipidsenkenden Effekt verantwortlich.
Ein wässrig-alkoholischer Extrakt mit 46 % Caffeoylchinasäurederivaten senkte an hyperlipidämisierten Ratten nach mehrmaligen, intraperitonealen Gaben von 25 mg/kg die Triglyceridwerte um 33 % und die Cholesterinwerte um 45 %. Letztere sanken auch nach oraler Applikation [13].
Cholesterolsenkung und Hemmung der LDL-Oxidation sind wichtige Faktoren der Arterioskleroseprophylaxe.
Außerdem sind wässrige bzw. ethanolisch-wässrige Zubereitungen aus Artischocke in der Lage, die α-Amylase-Akivität in vitro zu hemmen, wobei dafür vor allem die phenolischen Inhaltsstoffe verantwortlich sind. Stark lipophile Extrakte (Hexan, Dichlormethan) ergaben keine Enzym hemmenden Effekte [9].
Die Hemmwirkung auf die Cholesterin-Biosynthese in vitro [16,17] korrespondiert mit Erfahrungsberichten aus denen hervorgeht, dass Artischocken-Zubereitungen bei dauerhafter Anwendung auch beim Menschen zur Senkung insbesondere des Cholesterin-Blutspiegels beitragen können [5]. Von Interesse sind in diesem Zusammenhang auch Untersuchungen, die darauf hinweisen, dass auch die für die Arteriosklerose-Entwicklung bedeutsame Oxidation von humanem LDL durch Artischockenblätter-Extrakt gehemmt werden kann.
In einer Doppelblindstudie wurde die Wirksamkeit eines Artischockenblätter-Extraktes (Droge-Extrakt-Verhältnis 25-35:1, Extraktionsmittel: Wasser) bei Hyperlipoproteinämie geprüft. 143 Patienten mit Gesamtcholesterin im Serum von > 7,3 mmol/l (> 280 mg/dl) erhielten für die Dauer von 6 Wochen 1800 mg/d Artischockenblätter-Extrakt oder Placebo. Das Gesamtcholesterin nahm in der Verum-Gruppe im Mittel um 18,5% und in der Placebo-Gruppe um 8,6% (Gruppen-Differenz p = 0,0001) ab. LDL-Cholesterin nahm in der Artischocken-Gruppe um 22,9 % ab, in der Placebo-Gruppe um 6,3 %. Das LDL/HDL-Verhältnis sank um 20,2 % in der Artischocken-Gruppe und um 7,2 % in der Placebo-Gruppe. Arzneimittelbedingte unerwünschte Ereignisse wurden nicht beobachtet [5]. In einer randomisierten placebo-kontrollierten Doppelblindstudie wurden Kapseln mit je 1280 mg eines standardisierten wässrigen Artischockenblätter-Extraktes (DEV 4-6:1) im Vergleich zu Placebo getestet. 1000 Patienten mit aktuellen Gesamtcholesterin-Werten von 6,0 bis 8,0 mmol/L wurden angeschrieben; 130 davon kamen zur Blut-Untersuchung in die Klinik; 75 konnten schließlich in die Studie eingeschlossen werden, von denen 73 (35 Placebo, 38 Verum) nach erfolgtem Abschluss der 12-wöchigen Behandlungsphase in die statistische ITT-Analyse einbezogen werden konnten. Neben den Laboranalysen der Blut-Lipide wurden zu Beginn und am Ende der Studie Befragungen zur Lebensqualität durchgeführt. Nach etwa 6-wöchiger Behandlung mussten die Teilnehmer außerdem mittels eines Fragebogens gezielte Auskünfte zu ihren Ernährungsgewohnheiten geben. Die primären Zielgrößen waren die Änderungen der Plasma-Lipide (Gesamt-Cholesterin, LDL- und HDL-Cholesterin, Triglyceride) zwischen Beginn und Abschluss der 12-wöchigen Behandlung. Sekundäre Parameter waren die Änderungen im Wohlbefinden, gemessen mit einem validierten Fragebogen mit 22 Items (Psychological General Well-Being Index nach Bowling) sowie die Erfassung von Nebenwirkungen. Die Mittelwerte des Gesamt-Cholesterins im Plasma fielen unter dem Verum um 4,2 % von 7,2 auf 6,9 nmol/mL und stiegen unter Placebo um 1,9 % von 6,9 auf 7,0 nmol/mL an. Der Gruppenunterschied war statistisch signifikant (p=0,025). Bei LDL- und HDL-Cholesterin sowie den Trigliceriden wurden keine signifikanten Gruppenunterschiede beobachtet. Das mittels psychometrischer Skala ermittelte allgemeine Wohlbefinden besserte sich unter Verum um 11 % und unter Placebo um 9 %. Berichtete Neben- oder Begleitwirkungen waren nicht in spezifischer Weise auf eine der beiden Behandlungsgruppen verteilt [18–20].
Kirchhoff et al. konnte die choleretische Wirkung in einer placebo-kontrollierten Studie mit Probanden zeigen. 30 bzw. 60 Minuten nach intraduodinaler Applikation von 1,92 g eines standardisierten Artischockenextraktes wurden bei 20 Probanden Steigerungen des Galleflusses um 127% bzw. 152% gemessen. Die Autoren schlossen daraus, dass der Artischockenextrakt zur Behandlung dyspeptischer Beschwerden, insbesondere bei Verdacht auf Funktionsstörungen der Gallesekretion geeignet ist [21].

In einer prospektiven, randomisierten, placebo-kontrollierten, doppelblinden, multi-zentrischen Parallelgruppen-Vergleichsstudie wurde untersucht, ob die Gabe von 3mal 2 Kapseln á 320 mg eines Artischockenblätter-Extraktes (ALE) der Behandlung mit pharmakologisch inaktivem Placebo überlegen ist. Haupteinschlusskriterium war die Diagnose von chronischen Verdauungsbeschwerden, die hauptsächlich den Oberbauch betrafen und wenigstens mittelschwer ausgeprägt waren. Ausgeschlossen werden sollten Patienten mit Befund einer organischen Erkrankung und überwiegender Reflux- oder Reizdarmsymptomatik. Über die Therapiedauer von 6 Wochen wurde wöchentlich die Veränderung des dyspeptischen Beschwerdebildes abgefragt (Hauptzielkriterium). Nebenzielkriterien waren die Ausprägung der Symptome, sowie die Beurteilung von Wirksamkeit und Verträglichkeit durch den Arzt. Das Hauptzielkriterium wurde als Summenscore über den gesamten Therapiezeitraum ausgewertet (entsprechend dem chronisch rezidivierenden Verlauf der Erkrankung). In die Studie wurden 247 Patienten aus 30 Prüfzentren eingeschlossen. Das Intent-to-treat-Auswertungskollektiv umfasste die Daten von 244 Patienten. Die Auswertung des Hauptzielkriteriums ergab über den Verlauf von 6 Wochen im Vergleich der beiden Therapiearme eine signifikante Überlegenheit von ALE gegenüber Placebo [16,22].
Kürzlich wurde eine randomisierte, doppelblinde, placebo-kontrollierte Studie mit einem standardisierten ethanolischen Artischockenblütenextrakt an 55 übergewichtigen Probanden mit einem gestörten Zuckerhaushalt durchgeführt (Nüchternblutzucker: 6,11 ± 0,56 mmol/l). Die Probanden bekamen für 8 Wochen 3 x täglich 200 mg Artischockenextrakt in Form von Filmtabletten oder Placebo. Die Abnahme des Nüchternblutzuckers war das primäre Untersuchungsziel. Das glykosylierte Hämoglobin, die HbA1c abgeleitete durchschnittliche Glukose, die Blutfettwerte und anthropometrischen Parameter waren die sekundären Endpunkte. Die Artischockengruppe zeigte signifikante Abnahmen von: Nüchternblutzucker, glykosylierten Hämoglobin, HbA1c abgeleitete durchschnittliche Glukose und der Blutfettwerte. Die Placebo-Gruppe zeigte keinen signifikanten Unterschied. Mit diesen Daten konnte die Wirksamkeit der Artischocke auf eine Reduzierung der metabolischen Zuckerparameter bei übergewichtigen Probanden mit gestörter Nüchternglukose dargestellt werden [23].
Ergebnisse aus Übersichtsarbeiten:
In einem systematischen Review zu Extraktzubereitungen aus Artischockenblättern wurden 3 randomisierte, placebokontrollierte Studien mit insgesamt 262 Teilnehmern eingeschlossen. Die Studien ergaben Hinweise auf eine signifikante Senkung des Gesamtcholesterins um bis zu 18,5 % nach einer Therapie über 42 Tage [10,24].


